胚系(林奇綜合徵,LS)和體細胞錯配修復蛋白缺陷(MMRd)與結直腸癌和子宮內膜癌有關。然而,其在亞洲人群中的預後影響尚不清楚。本前瞻性隊列研究旨在確定疑似 LS 癌症患者中胚系和體細胞 MMRd 的發生率和結果。入組了疑似 LS 的結直腸癌或子宮內膜癌患者,進行胚系 MMRd基因檢測(gMMRd),一部分患者也接受過MMR 蛋白免疫組織化學染色(pMMRd)。在 451 例入組患者中,36 例患者為 gMMRd(+)。與gMMRd(−)患者相比,gMMRd(+)患者的10年無復發生存率顯著更高(100% vs. 77.9%;p=0.006),而10年總生存率相似(100% vs. 90.9%;p=0.12)。在 102 例 pMMR 狀態可及的 gMMRd(−)患者中,13.7% 為 pMMRd(+)。gMMRd(−)pMMRd(+)患者的 5 年無復發生存率為 62.9%,gMMRd(−)pMMRd(−)患者的 5 年無復發生存率為 35.0%,均低於 gMMRd(+)患者(100%;p < 0.001)。本研究表明,在結直腸癌和子宮內膜癌患者中,LS 導致較好的結局,並強調了發現體細胞 MMRd 後進行胚系基因檢測的重要性。
研究背景
林奇綜合徵(LS)是最常見的遺傳性癌症綜合徵,是由參與錯配修復(MMR)機制的基因(包括MLH1、MSH2、MSH6和PMS2)的雜合胚系致病性變異引起的。由複製相關錯誤或DNA損傷(如甲基化、氧化或鏈間交聯)導致的DNA錯配造成鹼基錯配或單核苷酸插入/缺失錯誤,可被MSH2-MSH6二聚體(MutSα)識別。MutSα 與錯配的 DNA 鏈結合導致 MLH1-PMS2 二聚體(MutLα)的募集並啟動 DNA 修復過程。錯配修復基因的致病性變異(也稱為MMR缺陷,MMRd)導致基因組的微衛星區域高度不穩定,這些區域容易出現錯配錯誤。微衛星區域和基因組其他區域的突變積累導致腫瘤發生。林奇綜合徵是遺傳性結直腸癌(CRC)的最常見病因,也是子宮內膜癌(EC)的唯一遺傳性病因,約占所有子宮內膜癌病例的2.1%和結直腸腺癌的2.2%。
LS相關癌症具有多樣的病理和臨床特徵,在病理學、臨床特徵和結局上與非LS相關腫瘤不同。在疑似LS患者中,已採用多基因癌症panel檢測來識別基因型,導致診斷和管理更精準,因為每種基因型的癌症風險都得到了很好的描述。研究表明,LS相關CRC的預後優於錯配修復功能完整的CRC。然而,缺乏LS合併CRC和EC患者的長期結局數據,特別是對於亞洲人群。
隨著體細胞基因檢測和免疫組織化學(IHC)在疑似 LS 癌症患者中的應用越來越多,具有微衛星不穩定性(MSI)或 IHC 顯示腫瘤組織 MMR 蛋白表達缺失但沒有胚系 MMR 致病性變異的患者被識別出來。該人群具有異質性,包括MLH1啟動子高甲基化導致的林奇綜合徵特例,BRAF V600E體細胞突變被認為是散發性癌症,以及如果不存在上述兩種變異,「林奇樣綜合徵(LLS)」。由於病因多種多樣,且不常規進行腫瘤 MSI 或 MMR IHC 檢測,因此僅存在腫瘤病理 MMR 缺陷(pMMRd)而沒有胚系 MMR 缺陷(gMMRd)的患者的比例和結局尚不清楚。
本研究旨在探索中國疑似 LS 癌症患者隊列中胚系 MMR 缺陷(gMMRd)的發生率和長期結局。我們通過回顧性回顧腫瘤 IHC 染色進一步確定了 gMMRd(−)pMMRd(+)亞組,並將其長期結果與散發性癌症患者和胚系 MMR 缺陷患者進行了比較。從這項研究中獲得的信息將有助於更深入地理解腫瘤發生和 MMRd 之間的相互作用,以及 LS 患者和僅 pMMRd 患者的監測和管理策略。
研究結果
2018 年 7 月至 2021 年 1 月期間,台灣和信治癌中心醫院(KF-SYSCC)前瞻性入組了 451 例癌症患者。根據修訂後的Bethesda指南的臨床標準,入組患者被懷疑患有林奇綜合徵。入組標準包括在 50 歲之前被診斷出患有結直腸癌或子宮內膜癌,有 LS 相關癌症顯著家族史,有兩種或兩種以上 LS 相關癌症個人病史,或患有免疫組織化學(IHC)顯示 MMR 蛋白缺失的結直腸癌或子宮內膜腫瘤的成人。所有參與者在入組前都不知道他們的錯配修復基因變異狀態。臨床信息來自參與者調查、電子病歷和台灣癌症登記處。
研究人群和胚系MMR致病性變異(gMMRd)
本研究隊列包括 451 例癌症患者,根據修訂後的Bethesda指南,臨床懷疑患有林奇綜合徵。所有患者均為中國人,65.4%為女性,13.1%患有兩種或兩種以上癌症,中位發病年齡為43歲(範圍為23至75歲)。總體而言,36 例(8.0%)患者攜帶致病性 MMR 基因變異。在334例結直腸癌患者中,25例(7.5%)攜帶致病性MMR基因變異;在125例子宮內膜癌患者中,14例(11.2%)攜帶致病性MMR基因變異(表1)。在致病性變異攜帶者中,18例(50.0%)致病性變異發生於MLH1,15例(41.7%)發生於MSH2,2例(5.6%)發生於MSH6,1例(2.8%)發生於PMS2。
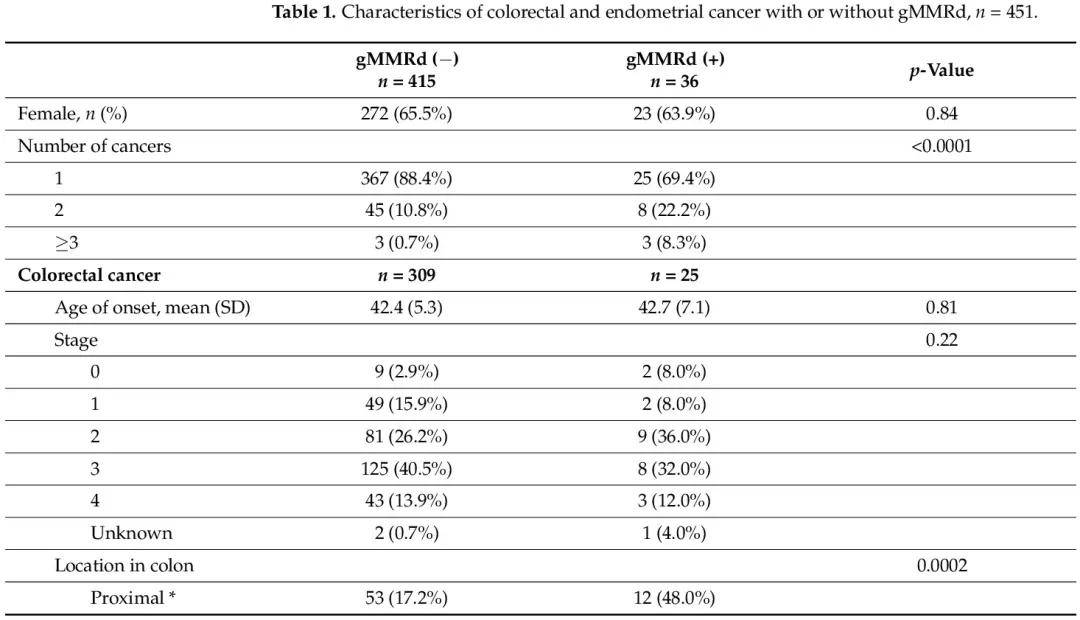
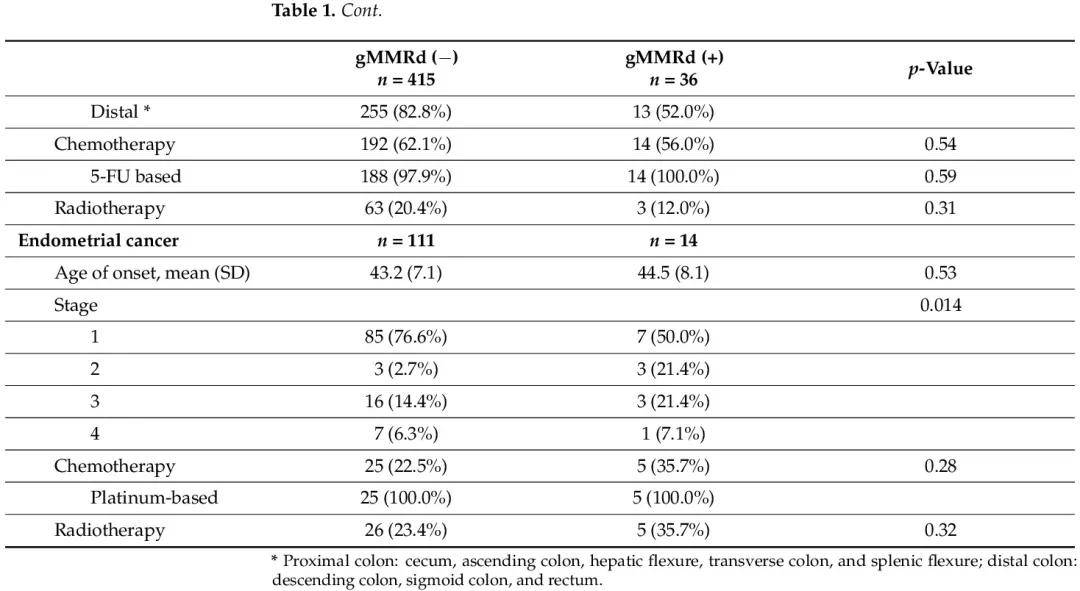
表1
表1比較了有和無gMMRd的患者的腫瘤特徵。在癌症診斷、治療或監測時,沒有患者知道他們的 MMR 基因變異狀態。gMMRd患者患多種癌症的可能性顯著增加(30.6% vs. 11.6%;p < 0.0001)。在結直腸癌患者中,gMMRd(+)患者更可能癌症位於近端結腸(48.0% vs. 17.2%;p = 0.0002)。其他特徵,包括發病年齡、癌症分期以及接受化療或放療,在有或無 gMMRd 的患者之間沒有顯著差異。在子宮內膜癌患者中,攜帶gMMRd的患者為2期或3期癌症(42.8% vs. 17.1%)而不是1期癌症(50.0% vs. 76.6%;p = 0.014)的幾率顯著更高。在發病年齡或接受化療或放療方面沒有顯著差異。
基於gMMRd狀態的結直腸癌和子宮內膜癌生存分析
為了評估gMMRd對結直腸癌或子宮內膜癌的預後價值,我們對有或無gMMRd的患者進行了生存分析,比較了兩組的無復發生存期(RFS)和總生存期(OS)(圖1)。中位隨訪 60.8 個月後,gMMRd(+)組 0 例患者復發或死亡,而無 gMMRd 組 83 例患者(20%)復發或死亡。gMMRd攜帶者10年無復發生存率為100%,而非攜帶者為77.9%(p = 0.006,圖1A)。10年時,gMMRd患者的總生存率為100%,而無gMMRd的患者為90.9%(p = 0.12,圖1B)。
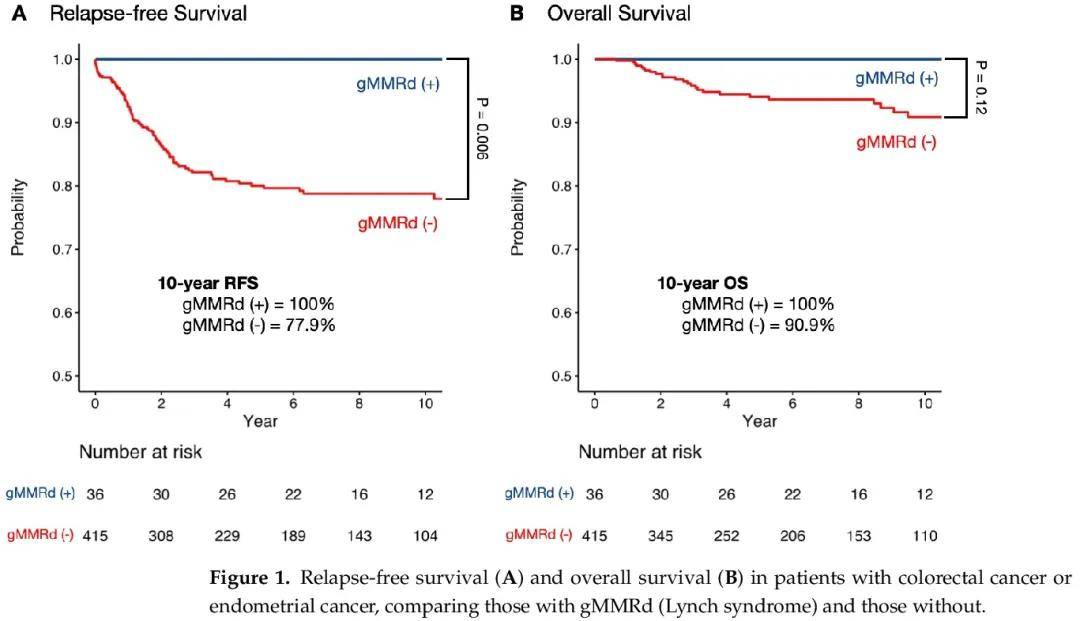
圖1
基於患者和腫瘤特徵的亞組分析(表 2)顯示,在以下亞組中,gMMRd(+)患者的無復發生存期顯著優於gMMRd(−)患者:男性、發病年齡小於 50 歲、結直腸癌診斷、IV 期癌症、接受過化療和未接受放療。
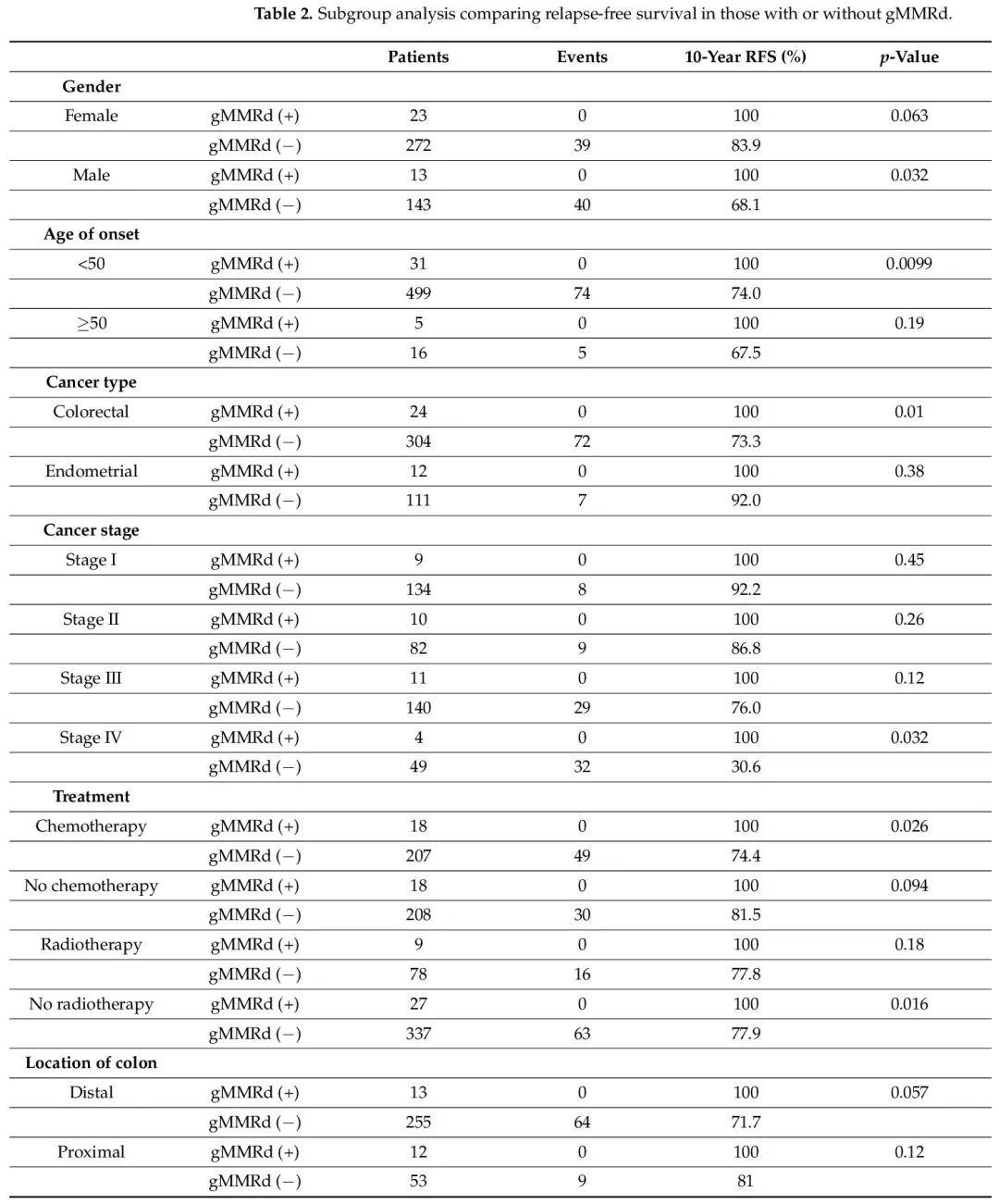
表2
基於gMMRd和pMMRd狀態的結直腸癌和子宮內膜癌患者的特徵和生存
從原始隊列中,我們獲取了 102 例無 gMMRd 患者的所有可及 IHC 染色結果,看腫瘤樣本的 pMMRd 狀態。我們發現其中14例(13.7%)為pMMRd(+)(表3)。gMMRd(+)、gMMRd(−)pMMRd(+)和 gMMRd(−)pMMRd(−)組的比較顯示,gMMRd(−)pMMRd(+)患者的發病年齡顯著高於其他兩組。其他特徵,包括腫瘤分期、接受化療或放療以及癌症類型,沒有顯著差異。
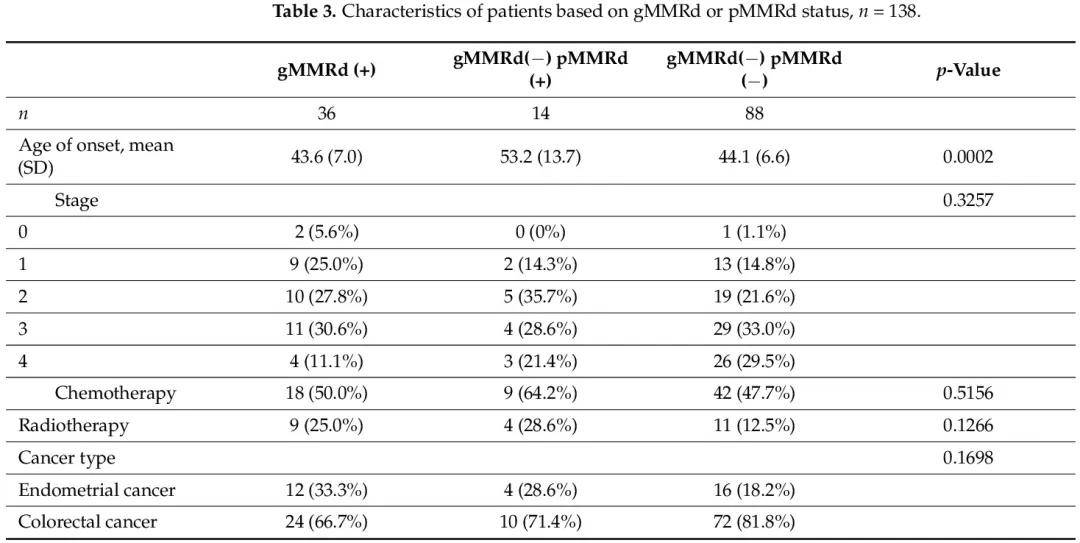
表3
生存分析顯示,gMMRd(+)組的 5 年無復發生存率為 100%,gMMRd(-)pMMRd(+)組為 62.9%,gMMRd(-)pMMRd(-)組為 35.0%(圖 2A)。根據多項比較調整的對數秩檢驗顯示,gMMRd(+)和 gMMRd(−)pMMRd(+)組之間以及 gMMRd(+)和 gMMRd(−)pMMRd(−)組之間存在顯著差異。gMMRd(+)組的 5 年總生存率為 100%,gMMRd(-)pMMRd(+)組為 92.3%,gMMRd(-)pMMRd(-)組為 73.5%(圖 2B)。根據多項比較調整的對數秩檢驗顯示,gMMRd(+)和 gMMRd(-)pMMRd(-)組之間的總生存期存在顯著差異。
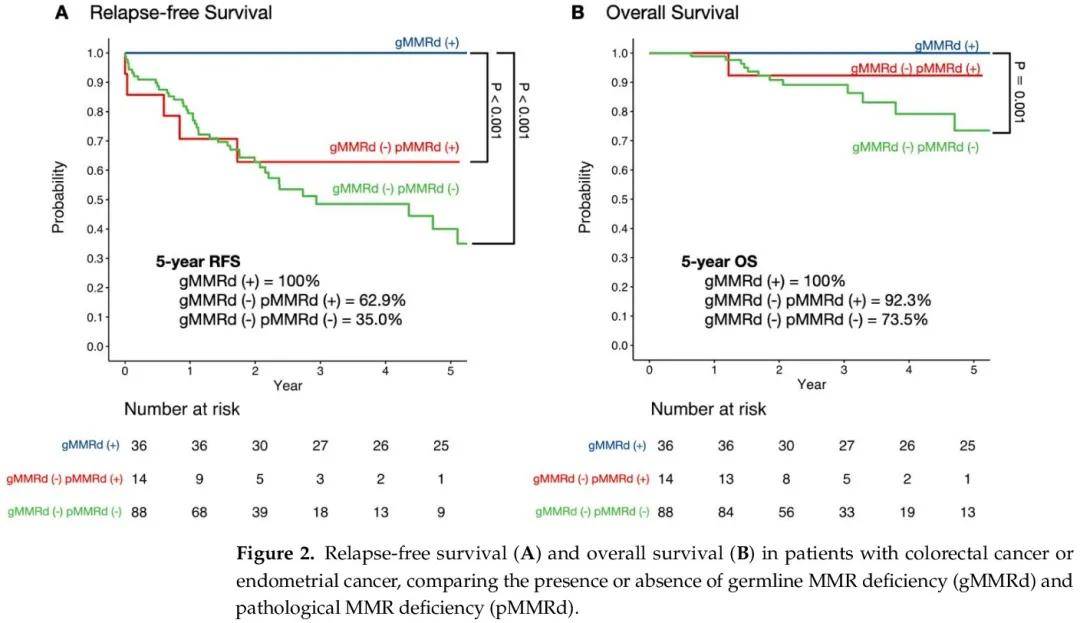
圖2
討 論
在這項隊列研究中,我們探索了具有不同 gMMRd 和 pMMRd 狀態的患者的長期無復發和總生存期結局。gMMRd患者的無復發生存期顯著優於無gMMRd患者,無論pMMRd狀態如何(圖1A和圖2A)。關於總生存期,gMMRd(+)患者的結局優於gMMRd(−)pMMRd(−)患者(圖2B)。儘管在本研究中,100% 的無復發率和總生存率似乎令人驚訝,但以前的研究也表明 gMMRd(即林奇綜合徵)患者的生存率良好。一項納入1942例gMMRd攜帶者的歐洲資料庫研究顯示,10年粗生存率為同樣出色:任何癌症為87%,首個癌症為結直腸癌時為91%,首個癌症為子宮內膜癌時為98%。另一項中國隊列研究報道,林奇綜合徵患者的5年總生存率為97.6%,無復發生存率為78%。本研究結果支持現有文獻,提示中國結直腸癌或子宮內膜癌患者長達十年的良好生存結果。此外,我們觀察到,在特定亞組中(例如男性、發病年齡小於50歲、結直腸癌患者、IV期癌症患者和接受過化療的患者),林奇綜合徵患者的無復發生存期顯著優於無gMMRd的患者(表2)。由於我們的gMMRd(+)組沒有復發或死亡事件,我們無法分析基於特定MMR基因的潛在預後差異。然而,一項國際前瞻性研究納入了8500例gMMRd攜帶者,所有參與者累計隨訪年數為71713年,發現結直腸癌或子宮內膜癌基於特定基因的生存率沒有顯著差異。
隨著腫瘤分子檢測的發展,對gMMRd(−)pMMRd(+)人群的研究興趣日益濃厚。對於無gMMRd的pMMRd,有幾種機制,包括MLH1啟動子高甲基化(被認為是林奇綜合徵亞型)、BRAF V600E體細胞突變(被認為是散發性癌症)和林奇樣綜合徵(如果這兩種情況不存在)。既往研究表明,與gMMRd患者相比,MLH1啟動子高甲基化或BRAF V600E突變患者的預後更差。另一方面,林奇樣綜合徵的預後尚不清楚,因為其發生率低且關於發病機制的假設多種多樣。儘管 gMMRd(−)pMMRd(+)人群的組成存在異質性,但我們的結果(圖 2)顯示,與林奇綜合徵或 gMMRd(−)pMMRd(−)患者相比,這些患者的無復發生存期和總生存期中等(統計學上不顯著)。這一發現的臨床意義在於,當切除腫瘤的病理檢查顯示 pMMRd 時,胚系 MMR 基因檢測可能對預後至關重要,因為與 pMMRd 相比,gMMRd 的預後顯著更好。最近日本的一項隊列研究發現,林奇綜合徵和林奇樣綜合徵在臨床病理特徵上沒有顯著差異,這進一步強調了發現pMMRd後胚系基因診斷的重要性。
本研究的優勢包括隨訪時間長和對臨床疑似 LS 患者的全面基因組測序。我們還證明,在未被充分研究的亞洲人群中,與西方研究報道的相比,生存結局相當。雖然這是一項單機構研究,但本研究受益於該機構的標準化癌症治療和監測方案,確保了整個隊列中患者診治和結果評估的一致性。本研究有幾個局限性。首先,可能有助於闡明一些gMMRd(−)pMMRd(+)患者潛在原因的MLH1啟動子高甲基化和BRAF V600E突變數據不可及。其次,gMMRd(−)pMMRd(+)組缺乏足夠的患者來實現具有統計學意義的生存差異。對所有高危患者進行常規 MMR、IHC 或 MSI 檢測將增加可用於未來生存分析的數據。此外,我們缺乏關於較新的腫瘤檢測(例如,腫瘤突變負荷、腫瘤浸潤淋巴細胞)或較新的治療方式(例如,免疫檢查點抑制劑)的足夠數據來評估它們對結局的影響。這些局限性凸顯了在這一領域進行進一步研究的必要性。
我們對中國癌症患者的隊列研究顯示,與 gMMRd(-)pMMRd(-)患者相比,LS 患者的無復發生存期和總生存期較優,gMMRd(-)pMMRd(+)患者的結局中等(統計學上不顯著)。這些信息可能為這些患者提供更精準的癌症治療和監測策略鋪平道路。
參考文獻:
Yeh J-T, Peng H-P, Hung F-H, Hung C-F, Hsieh L-L, Yang A-S, Wang YA. Mismatch Repair (MMR) Gene Mutation Carriers Have Favorable Outcome in Colorectal and Endometrial Cancer: A Prospective Cohort Study. Cancers. 2024; 16(13):2342. https://doi.org/10.3390/cancers16132342