表皮生長因子受體變異體III(EGFRvIII)是一種基因內EGFR::EGFR.E1E8融合,由6個外顯子缺失和外顯子1-8融合引起的。EGFRvIII常發生於膠質母細胞瘤(一種高級別腦腫瘤)。然而,其在其他實體瘤中的存在特徵尚不明確。研究者回顧了2021年至2022年通過雜交捕獲610基因NGS檢測平台檢測的4331例實體瘤病例,其中17例檢測到EGFRvIII,包括16/238例(7%)腦腫瘤和1/301例(0.3%)乳腺腫瘤。EGFRvIII陽性腦腫瘤均為IDH1/2野生型的膠質母細胞瘤,大多數同時存在TERT啟動子突變(14/16例)、EGFR擴增(13/16例)和EGFR突變(8/16例)。唯一一例EGFRvIII陽性的乳腺病變發生在一位年輕女性患者。在非該機構接受檢測的另一例乳腺病例中報告了EGFRvIII,發生於一名年輕女性患者。2例EGFRvIII陽性的乳腺腫瘤均表現為高級別肉瘤樣形態。總之,EGFRvIII罕見,主要發生於膠質母細胞瘤,罕見發生於乳腺肉瘤樣腫瘤。這部分患者可能從化療和/或靶向抗EGFR治療中獲益。
研究背景
表皮生長因子受體(EGFR)是ERBB蛋白家族的一種跨膜受體酪氨酸激酶,該家族還包括其他三個密切相關的受體:ERBB2、ERBB3和ERBB4。EGFR配體包括表皮生長因子、轉化生長因子-α以及其他生長因子和配體。EGFR與細胞外配體結合後,與其他ERBB家族成員形成同源二聚體或異源二聚體,並變構激活其胞內受體激酶結構域。EGFR的激活啟動下游細胞內信號傳導,導致一系列效應,包括受控的細胞增殖、分化、遷移、黏附和凋亡。
EGFR擴增和EGFR過表達見於多種癌症類型,包括膠質母細胞瘤、非小細胞肺癌和乳腺癌。約50%的原發性膠質母細胞瘤患者發生EGFR擴增,而繼發性膠質母細胞瘤患者的這一比例為8%,非小細胞肺癌患者為5%。在膠質母細胞瘤中,EGFR擴增與腫瘤細胞中增加的EGFR表達和EGFR免疫組織化學染色密切相關。EGFR基因突變見於多種類型的癌症,然而,不同類型腫瘤中EGFR的突變區域不同。在非小細胞肺癌中,最常見的激活突變是外顯子21的L858R和外顯子19的框內缺失,這兩個外顯子都位於細胞內激酶結構域內。相比之下,EGFR細胞外區的點突變,如R108K、A289V/D/T、G598D和其他細胞外區突變,在膠質母細胞瘤中普遍存在。這些細胞外結構域突變使EGFR保持活躍構象,據報道在24%的膠質母細胞瘤中存在。
在膠質母細胞瘤中也經常觀察到EGFR結構變異,即由EGFR外顯子缺失引起的一組基因內EGFR融合。膠質母細胞瘤中的EGFR剪接變異體包括EGFRvI(N端缺失)、EGFRvII(外顯子14-15缺失)、EGFRvIII(外顯子2-7框內缺失)、EGFRvIV(外顯子25-27缺失)和EGFRvV(外顯子25-58缺失);其中,EGFRvII和EGFRvIII已被證實具有組成性活性和致癌性。在膠質母細胞瘤中,EGFRvIII最常發生且常與晚期事件相關,發生於野生型EGFR擴增之後。EGFRvIII缺乏外顯子2-7;這些外顯子內267個胺基酸的缺失產生了一個與新的甘氨酸殘基的連接位點,導致外顯子1和8以及腫瘤特異性表位的框內融合。EGFRvIII持續激活,導致細胞內EGFR信號失調,導致腫瘤細胞生長和增殖失控,並對野生型EGFR治療藥物產生耐藥。在30-40%的膠質母細胞瘤病例中,EGFRvIII與EGFR擴增相關,並且EGFRvIII的表達是生存至少1年的膠質母細胞瘤患者總體生存的一個負預後標誌物。在這種情況下,直接靶向EGFR通路或激活針對EGFRvIII的免疫反應的特異性治療方法最近已經開發出來,並已作為單一療法或與標準替莫唑胺聯合應用於臨床試驗。
雖然EGFRvIII在膠質母細胞瘤中已得到充分認識,但在其他實體瘤中檢測EGFRvIII尚未得到充分確定。明確EGFRvIII在不同類型腫瘤中的分布可能有助於選擇更有效的靶向治療。NGS技術使快速準確鑑定EGFRvIII成為可能。本文描述了不同類型癌症患者的4331個樣本中EGFRvIII的分布。
研究結果
實體腫瘤中的EGFRvIII:
在經NGS測序的4331例癌症中,觀察到17例(0.4%)攜帶EGFRvIII:238例腦腫瘤中16例(7%);301例乳腺腫瘤中1例(0.3%);3792例其他類型惡性腫瘤中0例(0%),這些惡性腫瘤源自胃腸道、泌尿生殖系統、婦科、胸部、皮膚、頭頸部和骨骼(圖1)。在238例腦腫瘤中,有112例膠質母細胞瘤,其他126例腦腫瘤主要由IDH突變型星形細胞瘤和少突膠質細胞瘤構成。112例膠質母細胞瘤中,49例(44%)EGFR擴增,63例(56%)EGFR未擴增。112例膠質母細胞瘤中16例(14%)檢測到EGFRvIII,49例EGFR擴增的膠質母細胞瘤中13例(27%)檢測到EGFRvIII,63例EGFR非擴增的膠質母細胞瘤中3例(5%)檢測到EGFRvIII。在其他腦腫瘤中未檢測到EGFRvIII。剪接位點位於內含子1和內含子7,其中9例每個內含子有1個剪接位點,其餘8例每個內含子至少有2個剪接位點。8例同時存在EGFR突變,13例同時存在EGFR擴增。17例EGFRvIII陽性病例的腫瘤突變負荷均較低,並且微衛星狀態穩定(圖2)。
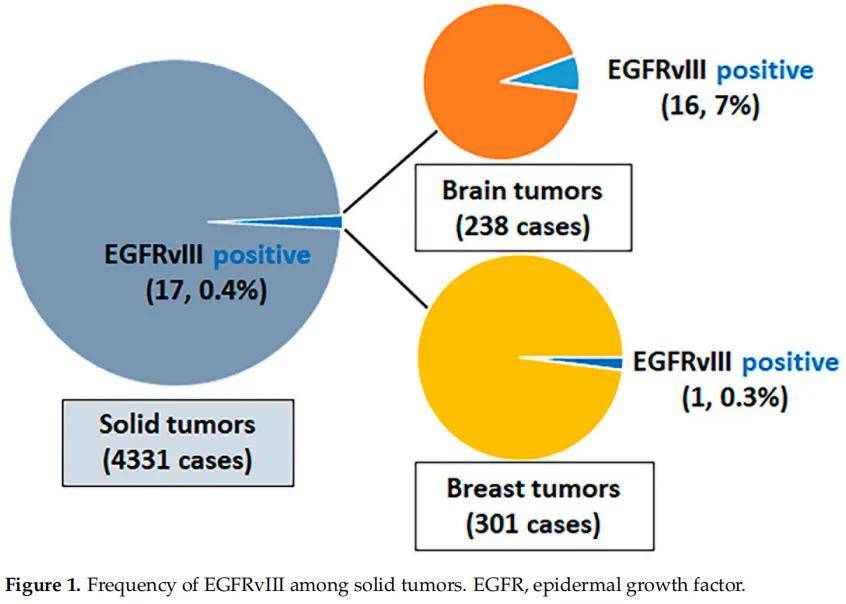
圖1
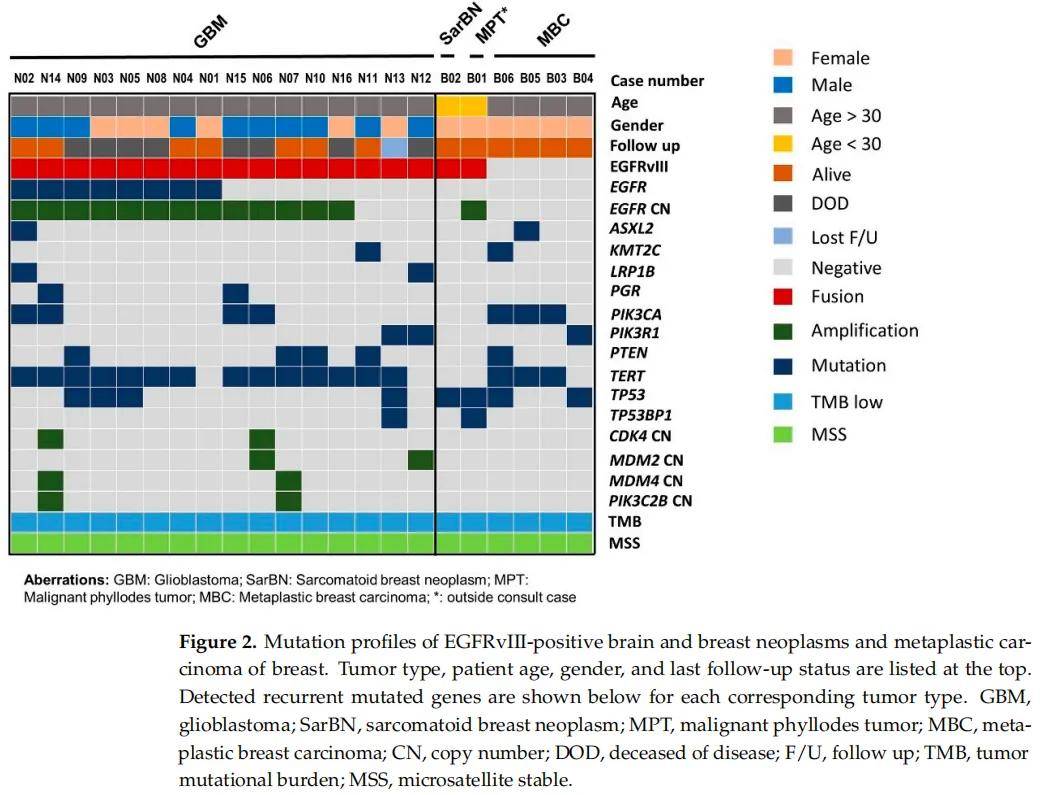
圖2
EGFRvIII陽性膠質母細胞瘤:
16例EGFRvIII陽性膠質母細胞瘤患者中,女性6例,男性10例;患者初診年齡為40-76歲,中位年齡為59歲。診斷後臨床隨訪時間為3-22個月,中位隨訪時間為14個月。16例均為IDH野生型原發性膠質母細胞瘤,中樞神經系統WHO分級4級。鏡下4例呈小細胞形態,其中3例同時存在EGFR擴增。2例進行了EGFR免疫組織化學染色,均顯示EGFR瀰漫性強表達(圖3)。報告有小細胞形態的EGFRvIII陽性膠質母細胞瘤患者的總生存期比報告無小細胞形態的EGFRvIII陽性膠質母細胞瘤患者差(平均7.9個月 vs. 17個月)。
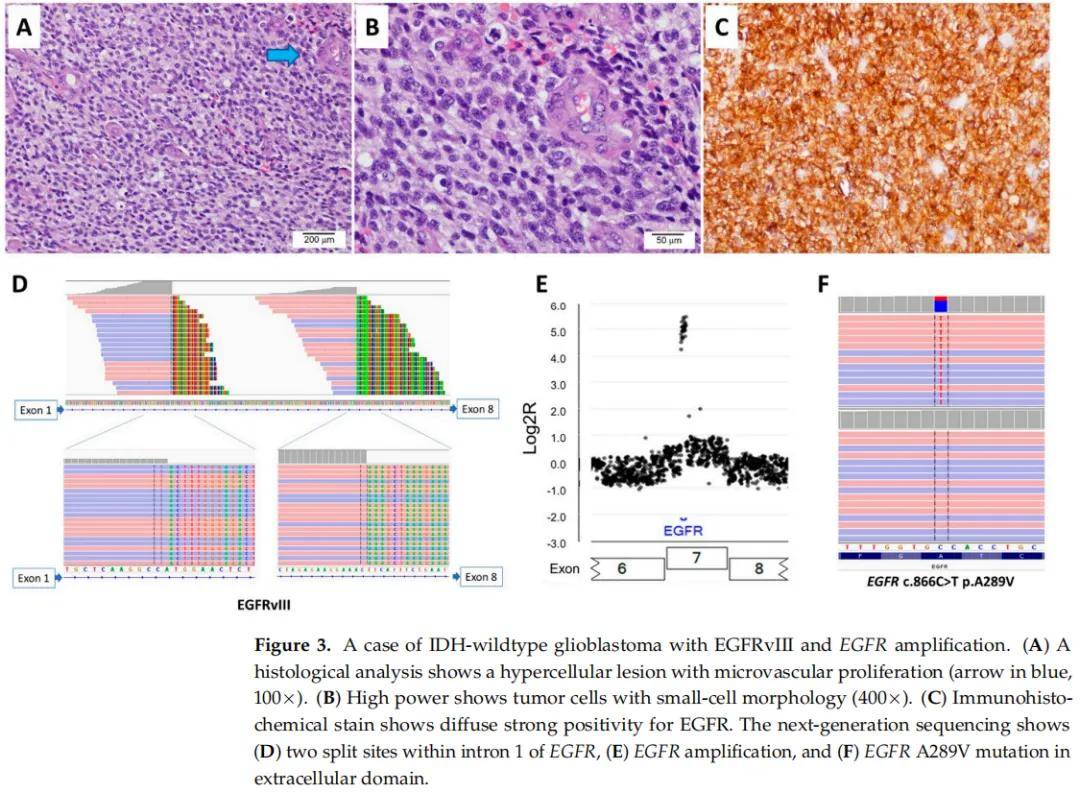
圖3
分子譜分析顯示所有16例患者為IDH野生型和組蛋白H3(H3)野生型,存在10號染色體拷貝數缺失。在所有16例患者中也觀察到了7號染色體拷貝數變異,其中11例(69%)有EGFR擴增和7號染色體增加,2例(13%)有EGFR擴增但無7號染色體增加,3例(19%)無EGFR擴增但有7號染色體拷貝數增加。8例(50%)患者存在EGFR突變(圖2)。16 例中14例存在最常見的共存突變TERT啟動子突變:8 例為c.-124C>T突變,6 例為c.-146C>T突變。第二常見的共存突變基因包括PIK3CA、PTEN和TP53,這三種基因的突變各出現在4例中。其他常見共存突變基因為PIK3R1、LRP1B和PGR,各2例。
EGFRvIII陽性乳腺腫瘤:
在NGS檢測的301例乳腺病變中,只有1例為EGFRvIII陽性(圖4),並且該腫瘤未顯示EGFR擴增(圖2)。其餘300例乳腺癌未檢測到EGFRvIII。EGFRvIII陽性的乳腺病變發生在1例年輕女性(<30歲),患有惡性高級別肉瘤樣腫瘤,具有梭形和上皮樣細胞,異質性結構特徵,局灶軟骨黏液樣間質。部分區域含有擴張的導管,伴有裂隙和大的鹿角形血管。大量有絲分裂象伴腫瘤壞死。免疫組織化學染色無法確定譜系。分子研究顯示,EGFRvIII的腫瘤突變負荷為1 mut/Mb,並且具有穩定的微衛星穩定性(圖4)。還檢測到了TP53和PIK3CG的體細胞突變,以及MYC、PTK2、RAD21、RECQL4和RSPO2的擴增。患者接受了化療和乳房切除術,在初次診斷後15個月隨訪時無病。
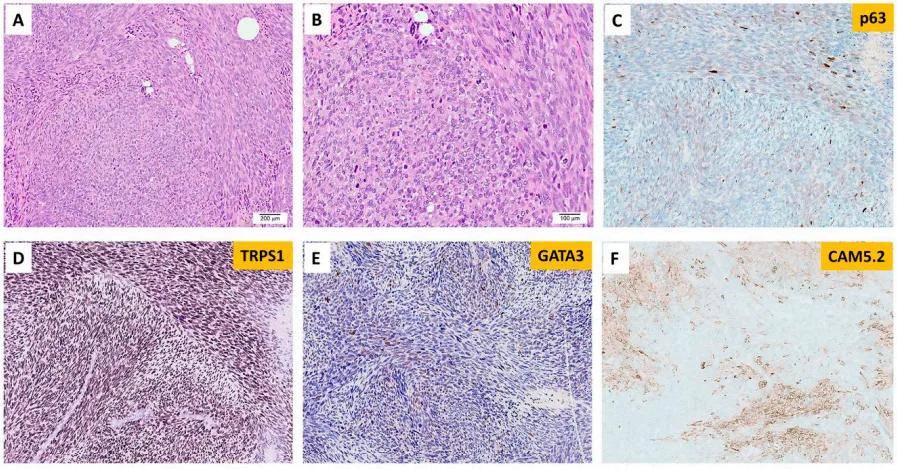
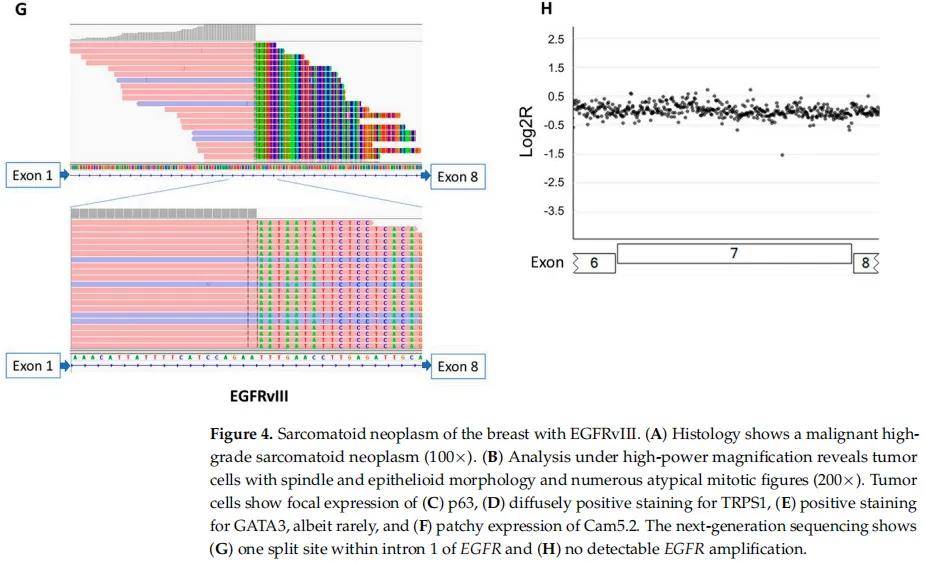
圖4
另一例 EGFRvIII乳腺病變病例未納入該隊列,該患者為1例被診斷為惡性葉狀腫瘤伴間質過度生長的年輕女性患者(圖5)。其他機構分子檢測報告顯示EGFRvIII、FYN、TP53和TP53BP1體細胞突變以及EGFR擴增。患者接受了手術,在12個月隨訪時無病。

圖5
研究者回顧了隊列中診斷或鑑別診斷為乳腺惡性肉瘤樣腫瘤的其餘病例。4例伴化生性癌,2例伴肉瘤樣/梭形,1例伴梭形/上皮樣,1例伴腺鱗分化。年齡範圍為50-69歲,平均年齡為64歲。所有患者均無EGFR變異(突變、擴增或融合)。在PIK3CA(3)、TERT(3)和TP53(2)中檢測到常見的體細胞突變。2例患者的TERT突變發生在啟動子(c.-124C>T)和1例患者的TERT突變發生在外顯子2(c.581G>A p.R194Q)(圖2)。
討 論
原發性膠質母細胞瘤是一種高級別瀰漫性星形細胞瘤,有絲分裂活性升高、微血管增殖、明顯的血管內纖維蛋白微血栓和壞死。通常是典型的IDH野生型和H3野生型。在IDH野生型膠質母細胞瘤中,常見且與診斷相關的分子變異包括TERT啟動子突變、EGFR基因擴增以及7號染色體拷貝數增加合併10號染色體拷貝數丟失(+7/-10基因型)。即使在沒有微血管增生和/或壞死的形態學證據的情況下,在IDH和H3野生型瀰漫性膠質瘤中至少存在一種這些變異就足以診斷為分子特徵性的IDH野生型膠質母細胞瘤。TERT編碼端粒酶,端粒酶在DNA複製過程中調節端粒長度,在正常體細胞衰老中發揮重要作用。TERT啟動子區域的突變導致端粒酶上調,從而導致端粒維持和腫瘤發生,這見於許多類型的腫瘤,包括膠質母細胞瘤。靶向端粒酶活性的抑制劑正在進行1/2期臨床試驗。
EGFR在IDH野生型膠質母細胞瘤中經常發生變異,約60%的腫瘤顯示EGFR擴增、突變、重排和/或剪接變異。在這些變異中,最常見的是EGFR擴增,大約40%的IDH野生型膠質母細胞瘤中觀察到EGFR擴增。在大多數病例中,EGFR擴增與第二種EGFR變異相關,如EGFR::SEPT14基因間融合,在4-8%的膠質母細胞瘤中發現;基因內融合EGFRvIII,在20-30%的膠質母細胞瘤中發現;EGFR細胞外區域的點突變,在24%的膠質母細胞瘤中發現。在早期的研究中,EGFRvIII的檢測主要通過單基因/位點RNA為基礎的逆轉錄聚合酶鏈反應(PCR)和/或免疫組織化學進行。在本研究使用NGS的研究中,在44%的膠質母細胞瘤中觀察到EGFR擴增,在14%的膠質母細胞瘤中觀察到EGFRvIII,這與之前的研究相似。
在本隊列研究中,膠質母細胞瘤PI3K通路中PIK3CA的激活突變或PTEN的失活突變可能與MAPK通路中的EGFRvIII共突變。小細胞形態是膠質母細胞瘤的一種亞型,主要表現為細胞具有高度單形性,小,圓形至微伸長,細胞核深染,細胞質極弱,細胞核非典型性很少,有絲分裂活性活躍。據報道,小細胞膠質母細胞瘤均為IDH野生型,在約70%的病例中顯示EGFR擴增。
小細胞形態與EGFRvIII的相關性尚未見報道。EGFRvIII在腫瘤中的表達是否與不良預後相關仍存在爭議。Shinojima等人在87例新診斷的膠質母細胞瘤患者中分析了EGFR基因擴增和突變的預後價值,並證明在EGFR基因擴增的情況下EGFRvIII表達是一個獨立指標,是生存預後差的最強指標。然而,Felsberg等人的研究(包括106例EGFR擴增的膠質母細胞瘤)表明,EGFRvIII陽性與不同的無進展生存率或總生存率無關。在本研究中,研究者發現EGFRvIII陽性的腦腫瘤病例均為原發性膠質母細胞瘤,IDH野生型和H3野生型伴10號染色體拷貝數丟失。大多數病例還存在EGFR擴增、EGFR體細胞突變(主要位於細胞外區域的第6-9號外顯子)和TERT啟動子突變。半數病例存在EGFRvIII的多個剪接位點。此外,EGFRvIII陽性膠質母細胞瘤的一個亞群表現為小細胞形態,其中75%的小細胞病例同時顯示EGFR擴增。與無小細胞形態的患者相比,小細胞形態組的總生存期較差。
值得注意的是,研究者還在該列中發現了1例無EGFR擴增或體細胞突變的EGFRvIII陽性乳腺病變,以及另1例在該機構外進行的檢測中報告有EGFRvIII和EGFR擴增的惡性葉狀腫瘤。2例患者均為青年女性,發病年齡均<30歲。鏡下2例均表現為高級別肉瘤樣腫瘤,1例表現為典型的葉狀腫瘤區。相反,本研究中的4例化生性癌均無EGFR變異。
EGFRvIII在乳腺腫瘤中的表達歷來存在爭議。早期使用巢式PCR的研究報道,通過巢式反轉錄PCR,乳腺癌中EGFRvIII的存在頻率可變。正常乳腺組織中未檢測到EGFRvIII。然而,在這些早期研究中,由於相對較短/特異性較低的引物設計,以及在巢式PCR中包含第二個PCR,因此很難評估報告的乳腺癌EGFRvIII陽性率的準確性,以及臨床無關/假陽性判定的可能性。相反,Rae等人的研究在55個乳腺癌細胞系和170個福馬林固定石蠟包埋的原發性乳腺癌組織中使用了針對EGFR的特異性引物的逆轉錄PCR,但未檢測到EGFRvIII mRNA。其他類型的EGFR基因內融合也極為罕見,其中只有1例乳腺癌病例(<0.1%)報告了EGFR基因內融合伴6個外顯子的框外缺失。
總之,關於EGFRvIII表達水平和表達EGFRvIII的乳腺癌比例的結果可能取決於檢測設計。EGFRvIII在乳腺惡性病變中的作用可能是肉瘤樣形態的驅動因素,需要更大樣本量的研究進一步證實。
EGFRvIII陽性的乳腺肉瘤樣病例的鑑別診斷包括化生性癌、伴間質過度生長的惡性葉狀腫瘤和原發性肉瘤。惡性葉狀腫瘤和化生性癌在形態學上有相似之處,特別是當主要由梭形細胞組成,但形態學上沒有可識別的上皮成分時,這給診斷帶來了挑戰。使用多個切片進行充分取樣可能有助於識別診斷特徵。然而,取樣可能有限,尤其是小的活檢標本。免疫組織化學染色有助於化生性癌的診斷,如惡性梭形細胞瀰漫表達細胞角蛋白或p63/p40。然而,在惡性葉狀腫瘤的基質成分中也有細胞角蛋白或p63/p40的斑片狀染色的報道。近年來,分子生物學研究為乳腺惡性葉狀腫瘤和化生性癌之間的基因差異提供了一些證據。Pareja等人研究了有或無纖維腺瘤樣區域的葉狀腫瘤的基因譜,發現在有纖維腺瘤樣區域的腫瘤中,MED12外顯子2突變的頻率顯著較高。然而,在沒有纖維腺瘤樣區域的腫瘤中,癌基因的富集更常見,尤其是EGFR突變和擴增。TERT基因變異的頻率無顯著差異。Gatalica等人對惡性葉狀腫瘤進行了多重NGS,發現24例中有8例(33%)有血管生成增加相關基因的過表達,尤其是EGFR擴增。最常見的突變包括TP53(50%)和PIK3CA(15%)。此外,還發現了兩種EGFR變異,包括EGFRvIII和EGFR V774M突變。到目前為止,本研究包括了第二例報道的攜帶EGFRvIII(基於NGS檢出)的惡性葉狀腫瘤。然而,化生性癌由一組具有獨特形態和瘤內異質性的異質性腫瘤組成。許多研究已經闡明化生性癌的分子特徵;然而,特異性的致病突變尚未確定。González-Martínez等人研究了化生性癌的分子譜,發現常見突變基因包括TP53(58.7%)、PIK3CA(32.8%)和TERT(29%),其中涉及PI3K通路的基因在梭形細胞癌中最常見。擴增頻率最高的基因為MYC(17.3%)。最常見的基因缺失為CDKN2A/CDKN2B位點。腫瘤抑制因子TP53編碼p53蛋白,而p53蛋白調節DNA修復、細胞凋亡和細胞周期。據報道,TP53突變在三陰性、HER2富集和轉移性乳腺癌中顯著高。在本隊列肉瘤樣乳腺腫瘤病例中,NGS顯示除了EGFRvIII融合外,還發現了涉及TP53和PIK3CG的基因突變,以及MYC、PTK2、RAD21、RECQL4和RSPO2的擴增。在惡性葉狀腫瘤中,除EGFRvIII融合外,還發現了TP53體細胞突變和EGFR擴增。此外,在本研究中,化生性癌病例中最常見的體細胞突變包括PIK3CA、TERT和TP53,沒有病例顯示EGFR變異。本研究病例顯示的分子特徵與González-Martínez等人報道的結果一致。
研究者回顧了一個大型的晚期惡性實體瘤病例隊列,通過NGS確定腦膠質母細胞瘤和乳腺肉瘤樣腫瘤中的EGFRvIII。治療腫瘤科醫師根據患者狀態、腫瘤類型和腫瘤分期決定將病例納入該隊列,以尋找潛在的治療干預措施。因此,每種癌症類型的樣本量可能存在偏倚。此外,MAPP檢測EGFRvIII可能受到其技術敏感性和分析前因素(包括但不限於福馬林固定產生的DNA降解和低腫瘤分數)的潛在限制。受限於EGFRvIII陽性膠質母細胞瘤病例數量較少,研究者無法就小細胞形態的存在進行有統計學功效的有意義生存分析。由於乳腺肉瘤樣腫瘤罕見,研究者無法進一步描述EGFRvIII在鑑別惡性葉狀腫瘤與乳腺化生性癌和原發性肉瘤中的診斷效用,這兩種腫瘤在組織學和免疫表型上有重疊。未來針對乳腺肉瘤樣腫瘤的研究可能有助於闡明每個實體的不同分子特徵。
總之,惡性腫瘤中的基因內EGFRvIII融合罕見,主要發生於膠質母細胞瘤,在乳腺腫瘤中很少發生,在本隊列中的其他腫瘤類型中沒有發現這種變異。值得注意的是,2例EGFRvIII陽性的乳腺病變均發生於年輕女性患者,表現為肉瘤樣形態,與之前描述的1例EGFRvIII陽性的惡性葉狀腫瘤相似。EGFRvIII在乳腺惡性病變中的作用可能是肉瘤樣形態的驅動因素,需要更大樣本量的研究進一步證實。鑒於針對EGFRvIII的泛HER抑制劑、多肽和嵌合抗原受體T免疫療法等藥物在臨床試驗中的出現,這一經過選擇的患者群體可能從化療或靶向抗EGFR治療中獲益。
參考文獻:
Zheng L, Luthra R, Alvarez HA, et al. Intragenic EGFR::EGFR.E1E8 Fusion (EGFRvIII) in 4331 Solid Tumors. Cancers (Basel). 2023;16(1):6. Published 2023 Dec 19. doi:10.3390/cancers16010006