结直肠癌和子宫内膜癌不要错过MMR胚系检测,明确遗传风险和预测生存预后!
胚系(林奇综合征,LS)和体细胞错配修复蛋白缺陷(MMRd)与结直肠癌和子宫内膜癌有关。然而,其在亚洲人群中的预后影响尚不清楚。本前瞻性队列研究旨在确定疑似 LS 癌症患者中胚系和体细胞 MMRd 的发生率和结果。入组了疑似 LS 的结直肠癌或子宫内膜癌患者,进行胚系 MMRd基因检测(gMMRd),一部分患者也接受过MMR 蛋白免疫组织化学染色(pMMRd)。在 451 例入组患者中,36 例患者为 gMMRd(+)。与gMMRd(−)患者相比,gMMRd(+)患者的10年无复发生存率显著更高(100% vs. 77.9%;p=0.006),而10年总生存率相似(100% vs. 90.9%;p=0.12)。在 102 例 pMMR 状态可及的 gMMRd(−)患者中,13.7% 为 pMMRd(+)。gMMRd(−)pMMRd(+)患者的 5 年无复发生存率为 62.9%,gMMRd(−)pMMRd(−)患者的 5 年无复发生存率为 35.0%,均低于 gMMRd(+)患者(100%;p < 0.001)。本研究表明,在结直肠癌和子宫内膜癌患者中,LS 导致较好的结局,并强调了发现体细胞 MMRd 后进行胚系基因检测的重要性。
研究背景
林奇综合征(LS)是最常见的遗传性癌症综合征,是由参与错配修复(MMR)机制的基因(包括MLH1、MSH2、MSH6和PMS2)的杂合胚系致病性变异引起的。由复制相关错误或DNA损伤(如甲基化、氧化或链间交联)导致的DNA错配造成碱基错配或单核苷酸插入/缺失错误,可被MSH2-MSH6二聚体(MutSα)识别。MutSα 与错配的 DNA 链结合导致 MLH1-PMS2 二聚体(MutLα)的募集并启动 DNA 修复过程。错配修复基因的致病性变异(也称为MMR缺陷,MMRd)导致基因组的微卫星区域高度不稳定,这些区域容易出现错配错误。微卫星区域和基因组其他区域的突变积累导致肿瘤发生。林奇综合征是遗传性结直肠癌(CRC)的最常见病因,也是子宫内膜癌(EC)的唯一遗传性病因,约占所有子宫内膜癌病例的2.1%和结直肠腺癌的2.2%。
LS相关癌症具有多样的病理和临床特征,在病理学、临床特征和结局上与非LS相关肿瘤不同。在疑似LS患者中,已采用多基因癌症panel检测来识别基因型,导致诊断和管理更精准,因为每种基因型的癌症风险都得到了很好的描述。研究表明,LS相关CRC的预后优于错配修复功能完整的CRC。然而,缺乏LS合并CRC和EC患者的长期结局数据,特别是对于亚洲人群。
随着体细胞基因检测和免疫组织化学(IHC)在疑似 LS 癌症患者中的应用越来越多,具有微卫星不稳定性(MSI)或 IHC 显示肿瘤组织 MMR 蛋白表达缺失但没有胚系 MMR 致病性变异的患者被识别出来。该人群具有异质性,包括MLH1启动子高甲基化导致的林奇综合征特例,BRAF V600E体细胞突变被认为是散发性癌症,以及如果不存在上述两种变异,“林奇样综合征(LLS)”。由于病因多种多样,且不常规进行肿瘤 MSI 或 MMR IHC 检测,因此仅存在肿瘤病理 MMR 缺陷(pMMRd)而没有胚系 MMR 缺陷(gMMRd)的患者的比例和结局尚不清楚。
本研究旨在探索中国疑似 LS 癌症患者队列中胚系 MMR 缺陷(gMMRd)的发生率和长期结局。我们通过回顾性回顾肿瘤 IHC 染色进一步确定了 gMMRd(−)pMMRd(+)亚组,并将其长期结果与散发性癌症患者和胚系 MMR 缺陷患者进行了比较。从这项研究中获得的信息将有助于更深入地理解肿瘤发生和 MMRd 之间的相互作用,以及 LS 患者和仅 pMMRd 患者的监测和管理策略。
研究结果
2018 年 7 月至 2021 年 1 月期间,台湾和信治癌中心医院(KF-SYSCC)前瞻性入组了 451 例癌症患者。根据修订后的Bethesda指南的临床标准,入组患者被怀疑患有林奇综合征。入组标准包括在 50 岁之前被诊断出患有结直肠癌或子宫内膜癌,有 LS 相关癌症显著家族史,有两种或两种以上 LS 相关癌症个人病史,或患有免疫组织化学(IHC)显示 MMR 蛋白缺失的结直肠癌或子宫内膜肿瘤的成人。所有参与者在入组前都不知道他们的错配修复基因变异状态。临床信息来自参与者调查、电子病历和台湾癌症登记处。
研究人群和胚系MMR致病性变异(gMMRd)
本研究队列包括 451 例癌症患者,根据修订后的Bethesda指南,临床怀疑患有林奇综合征。所有患者均为中国人,65.4%为女性,13.1%患有两种或两种以上癌症,中位发病年龄为43岁(范围为23至75岁)。总体而言,36 例(8.0%)患者携带致病性 MMR 基因变异。在334例结直肠癌患者中,25例(7.5%)携带致病性MMR基因变异;在125例子宫内膜癌患者中,14例(11.2%)携带致病性MMR基因变异(表1)。在致病性变异携带者中,18例(50.0%)致病性变异发生于MLH1,15例(41.7%)发生于MSH2,2例(5.6%)发生于MSH6,1例(2.8%)发生于PMS2。
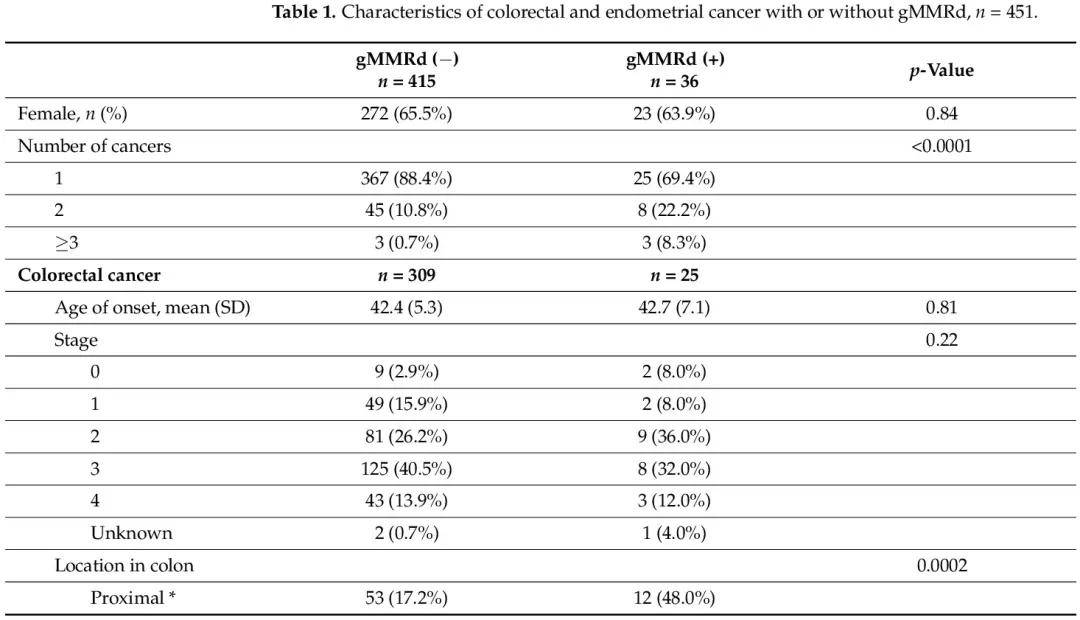
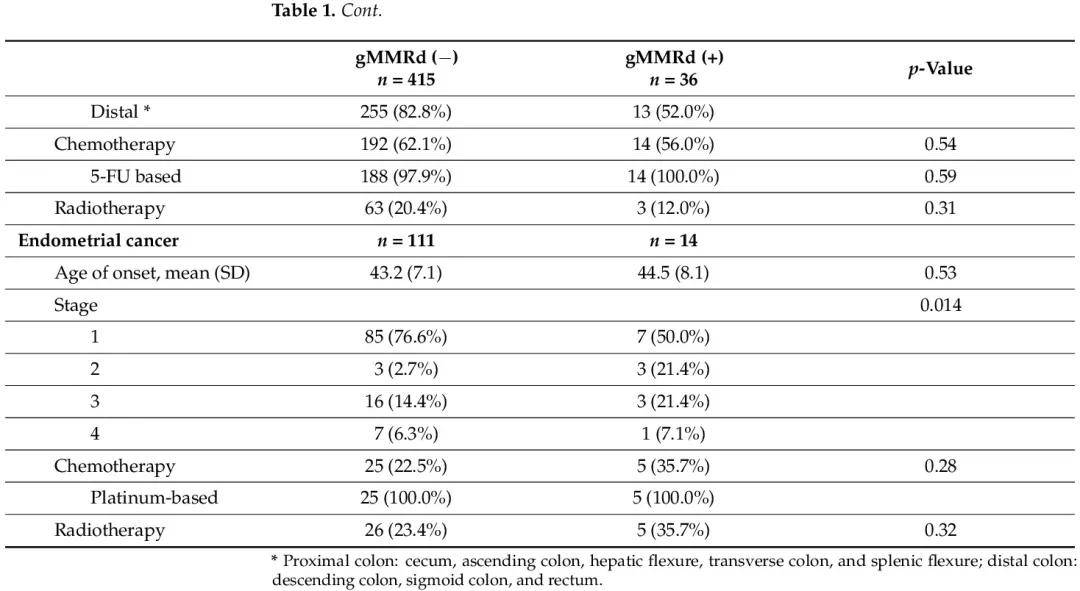
表1
表1比较了有和无gMMRd的患者的肿瘤特征。在癌症诊断、治疗或监测时,没有患者知道他们的 MMR 基因变异状态。gMMRd患者患多种癌症的可能性显著增加(30.6% vs. 11.6%;p < 0.0001)。在结直肠癌患者中,gMMRd(+)患者更可能癌症位于近端结肠(48.0% vs. 17.2%;p = 0.0002)。其他特征,包括发病年龄、癌症分期以及接受化疗或放疗,在有或无 gMMRd 的患者之间没有显著差异。在子宫内膜癌患者中,携带gMMRd的患者为2期或3期癌症(42.8% vs. 17.1%)而不是1期癌症(50.0% vs. 76.6%;p = 0.014)的几率显著更高。在发病年龄或接受化疗或放疗方面没有显著差异。
基于gMMRd状态的结直肠癌和子宫内膜癌生存分析
为了评估gMMRd对结直肠癌或子宫内膜癌的预后价值,我们对有或无gMMRd的患者进行了生存分析,比较了两组的无复发生存期(RFS)和总生存期(OS)(图1)。中位随访 60.8 个月后,gMMRd(+)组 0 例患者复发或死亡,而无 gMMRd 组 83 例患者(20%)复发或死亡。gMMRd携带者10年无复发生存率为100%,而非携带者为77.9%(p = 0.006,图1A)。10年时,gMMRd患者的总生存率为100%,而无gMMRd的患者为90.9%(p = 0.12,图1B)。
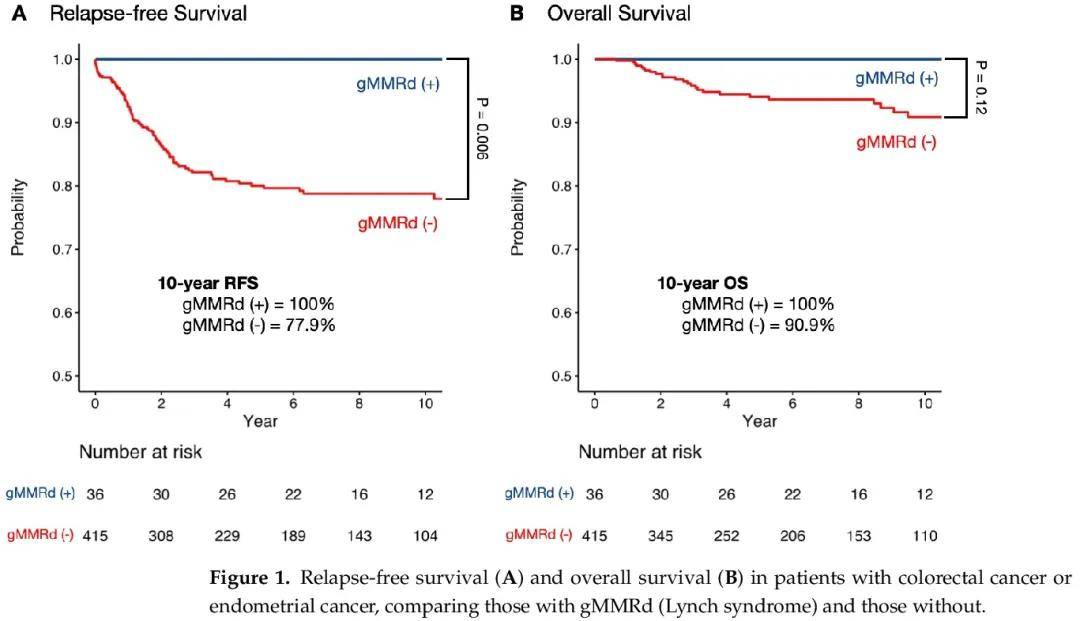
图1
基于患者和肿瘤特征的亚组分析(表 2)显示,在以下亚组中,gMMRd(+)患者的无复发生存期显著优于gMMRd(−)患者:男性、发病年龄小于 50 岁、结直肠癌诊断、IV 期癌症、接受过化疗和未接受放疗。
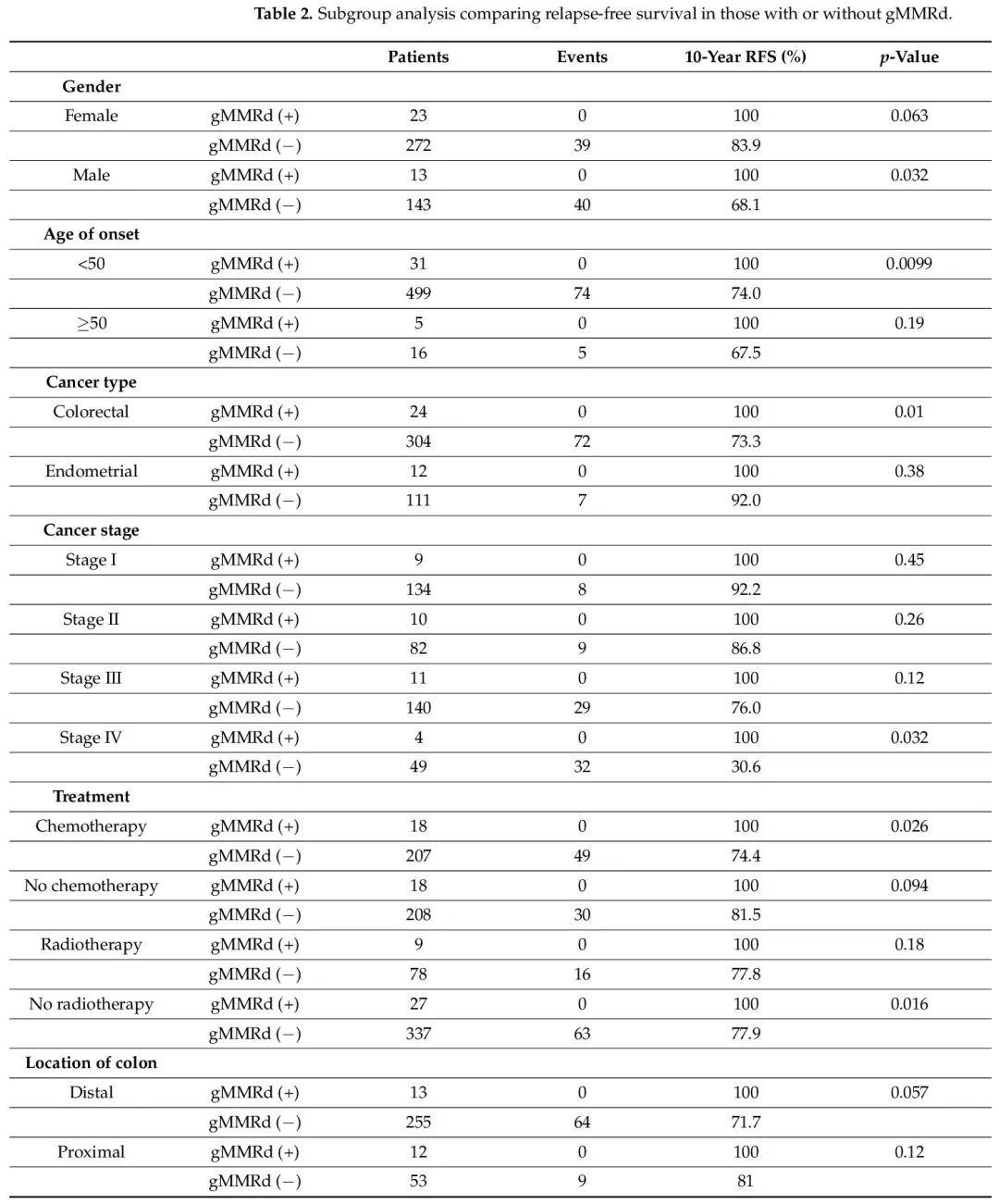
表2
基于gMMRd和pMMRd状态的结直肠癌和子宫内膜癌患者的特征和生存
从原始队列中,我们获取了 102 例无 gMMRd 患者的所有可及 IHC 染色结果,看肿瘤样本的 pMMRd 状态。我们发现其中14例(13.7%)为pMMRd(+)(表3)。gMMRd(+)、gMMRd(−)pMMRd(+)和 gMMRd(−)pMMRd(−)组的比较显示,gMMRd(−)pMMRd(+)患者的发病年龄显著高于其他两组。其他特征,包括肿瘤分期、接受化疗或放疗以及癌症类型,没有显著差异。
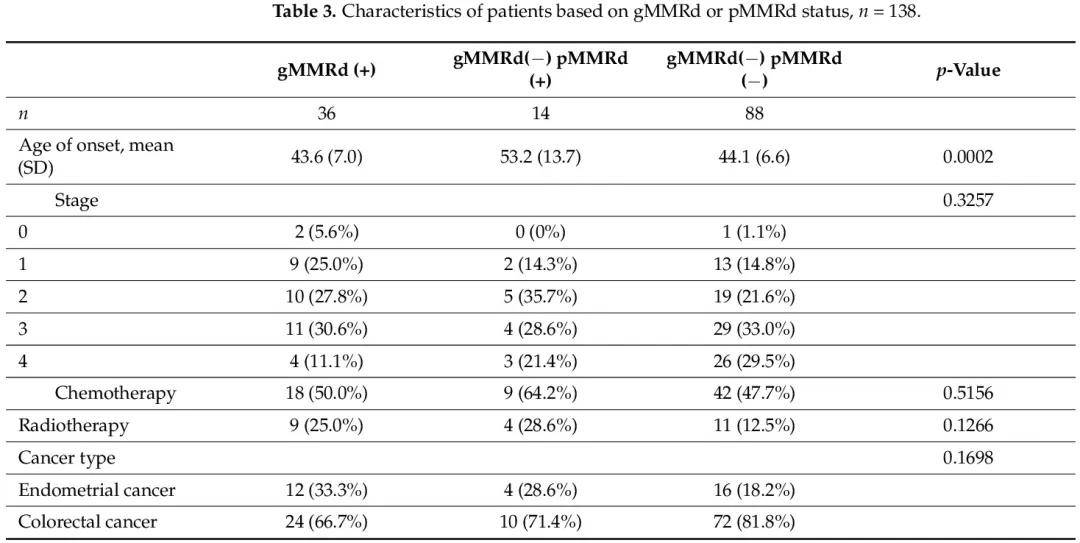
表3
生存分析显示,gMMRd(+)组的 5 年无复发生存率为 100%,gMMRd(-)pMMRd(+)组为 62.9%,gMMRd(-)pMMRd(-)组为 35.0%(图 2A)。根据多项比较调整的对数秩检验显示,gMMRd(+)和 gMMRd(−)pMMRd(+)组之间以及 gMMRd(+)和 gMMRd(−)pMMRd(−)组之间存在显著差异。gMMRd(+)组的 5 年总生存率为 100%,gMMRd(-)pMMRd(+)组为 92.3%,gMMRd(-)pMMRd(-)组为 73.5%(图 2B)。根据多项比较调整的对数秩检验显示,gMMRd(+)和 gMMRd(-)pMMRd(-)组之间的总生存期存在显著差异。
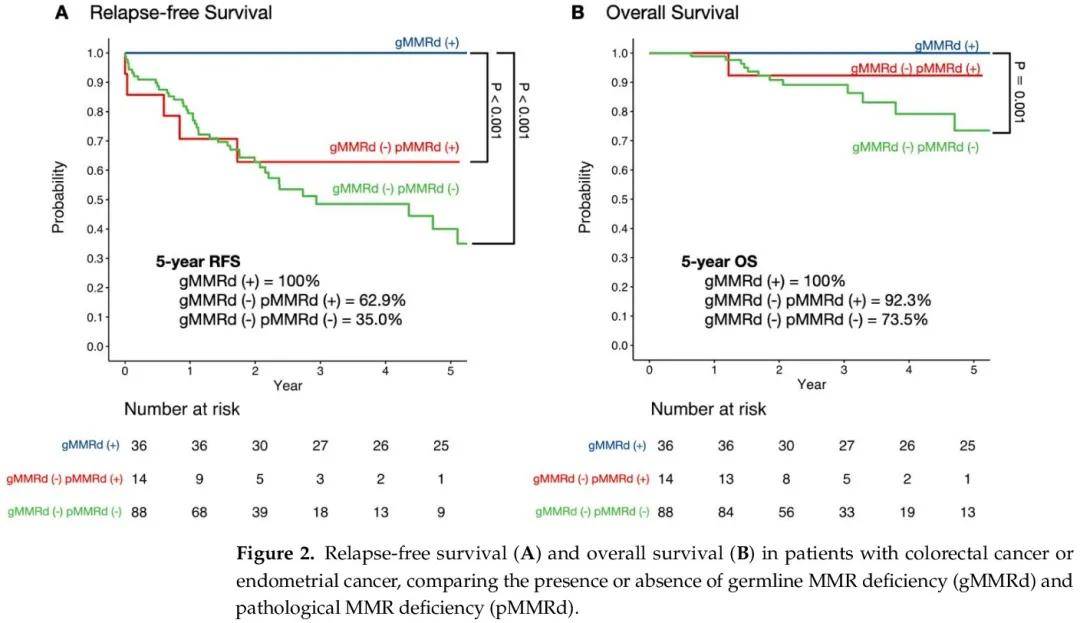
图2
讨 论
在这项队列研究中,我们探索了具有不同 gMMRd 和 pMMRd 状态的患者的长期无复发和总生存期结局。gMMRd患者的无复发生存期显著优于无gMMRd患者,无论pMMRd状态如何(图1A和图2A)。关于总生存期,gMMRd(+)患者的结局优于gMMRd(−)pMMRd(−)患者(图2B)。尽管在本研究中,100% 的无复发率和总生存率似乎令人惊讶,但以前的研究也表明 gMMRd(即林奇综合征)患者的生存率良好。一项纳入1942例gMMRd携带者的欧洲数据库研究显示,10年粗生存率为同样出色:任何癌症为87%,首个癌症为结直肠癌时为91%,首个癌症为子宫内膜癌时为98%。另一项中国队列研究报道,林奇综合征患者的5年总生存率为97.6%,无复发生存率为78%。本研究结果支持现有文献,提示中国结直肠癌或子宫内膜癌患者长达十年的良好生存结果。此外,我们观察到,在特定亚组中(例如男性、发病年龄小于50岁、结直肠癌患者、IV期癌症患者和接受过化疗的患者),林奇综合征患者的无复发生存期显著优于无gMMRd的患者(表2)。由于我们的gMMRd(+)组没有复发或死亡事件,我们无法分析基于特定MMR基因的潜在预后差异。然而,一项国际前瞻性研究纳入了8500例gMMRd携带者,所有参与者累计随访年数为71713年,发现结直肠癌或子宫内膜癌基于特定基因的生存率没有显著差异。
随着肿瘤分子检测的发展,对gMMRd(−)pMMRd(+)人群的研究兴趣日益浓厚。对于无gMMRd的pMMRd,有几种机制,包括MLH1启动子高甲基化(被认为是林奇综合征亚型)、BRAF V600E体细胞突变(被认为是散发性癌症)和林奇样综合征(如果这两种情况不存在)。既往研究表明,与gMMRd患者相比,MLH1启动子高甲基化或BRAF V600E突变患者的预后更差。另一方面,林奇样综合征的预后尚不清楚,因为其发生率低且关于发病机制的假设多种多样。尽管 gMMRd(−)pMMRd(+)人群的组成存在异质性,但我们的结果(图 2)显示,与林奇综合征或 gMMRd(−)pMMRd(−)患者相比,这些患者的无复发生存期和总生存期中等(统计学上不显著)。这一发现的临床意义在于,当切除肿瘤的病理检查显示 pMMRd 时,胚系 MMR 基因检测可能对预后至关重要,因为与 pMMRd 相比,gMMRd 的预后显著更好。最近日本的一项队列研究发现,林奇综合征和林奇样综合征在临床病理特征上没有显著差异,这进一步强调了发现pMMRd后胚系基因诊断的重要性。
本研究的优势包括随访时间长和对临床疑似 LS 患者的全面基因组测序。我们还证明,在未被充分研究的亚洲人群中,与西方研究报道的相比,生存结局相当。虽然这是一项单机构研究,但本研究受益于该机构的标准化癌症治疗和监测方案,确保了整个队列中患者诊治和结果评估的一致性。本研究有几个局限性。首先,可能有助于阐明一些gMMRd(−)pMMRd(+)患者潜在原因的MLH1启动子高甲基化和BRAF V600E突变数据不可及。其次,gMMRd(−)pMMRd(+)组缺乏足够的患者来实现具有统计学意义的生存差异。对所有高危患者进行常规 MMR、IHC 或 MSI 检测将增加可用于未来生存分析的数据。此外,我们缺乏关于较新的肿瘤检测(例如,肿瘤突变负荷、肿瘤浸润淋巴细胞)或较新的治疗方式(例如,免疫检查点抑制剂)的足够数据来评估它们对结局的影响。这些局限性凸显了在这一领域进行进一步研究的必要性。
我们对中国癌症患者的队列研究显示,与 gMMRd(-)pMMRd(-)患者相比,LS 患者的无复发生存期和总生存期较优,gMMRd(-)pMMRd(+)患者的结局中等(统计学上不显著)。这些信息可能为这些患者提供更精准的癌症治疗和监测策略铺平道路。
参考文献:
Yeh J-T, Peng H-P, Hung F-H, Hung C-F, Hsieh L-L, Yang A-S, Wang YA. Mismatch Repair (MMR) Gene Mutation Carriers Have Favorable Outcome in Colorectal and Endometrial Cancer: A Prospective Cohort Study. Cancers. 2024; 16(13):2342. https://doi.org/10.3390/cancers16132342