III期肺大细胞神经内分泌癌患者检出ALK融合,一线阿来替尼治疗带来临床获益!
肺大细胞神经内分泌癌(L-LCNEC)是肺癌的一个亚型,其发病率低,恶性程度高。对于早期患者,手术治疗受限,且术后复发的风险高。对于无法切除或晚期的患者,以铂类为基础的化疗是目前的主要治疗方法,但其疗效并不令人满意。带有间变性淋巴瘤激酶(ALK)基因突变的L-LCNEC非常罕见,目前没有标准疗法。在这篇文章中,我们报告了一个携带ALK基因突变的局部晚期L-LCNEC的患者 ,接受阿来替尼一线治疗。该患者为一名既往健康的46岁非吸烟女性,被临床诊断为患有不可切除的局部晚期L-LCNEC。患者血浆和肿瘤标本的下一代测序(NGS)显示棘皮动物微管相关蛋白样4(EML-4)(外显子13)-ALK(外显子20)融合,突变丰度分别为14.48%和15.37%。患者拒绝化疗,并接受了阿来替尼一线治疗,服用剂量 600mg,一日两次。在服用阿来替尼1个月后,患者的胸部增强计算机断层扫描(CT)显示出部分缓解(PR)。在使用阿来替尼治疗12个月后,影像学评估显示,患者保持了PR。治疗开始时观察到患者有2-3级的皮疹。经过对症治疗后,皮疹消失,且副作用完全耐受。目前,患者可以正常工作,功能状态为0,未发生任何重大不良事件。病例表明,对具有基因突变III期的L-LCNEC患者在一线使用靶向治疗也是一个不错的选择。其副作用轻,患者耐受性好,并可提高生活质量。
背 景
肺大细胞神经内分泌癌(L-LCNEC)是神经内分泌肿瘤(NET)的一种类型。它是一种罕见的、低分化且高度恶性的肺部肿瘤。它在所有肺部恶性肿瘤中的占比<3%。L-LCNEC被定义为一种非小细胞肺癌(NSCLC)。它具有侵袭、广泛转移和存活率低的特点。其临床特征和预后与小细胞肺癌(SCLC)相似。由于其非常罕见,目前对其诊断、治疗和预后仍存在诸多争议,相关治疗和预后指标缺乏大样本研究和文献数据支持。
大量的基因突变已被证明可以驱动一系列人类癌症类型的恶性转化和细胞增殖,包括肺癌。间变性淋巴瘤激酶 (ALK)基因重排发生在~5%的肺癌中,是靶向治疗的一个生物标志物。迄今为止,包括阿来替尼在内的几种ALK抑制剂已经被开发出来,并作为对铂类双药化疗耐药的患者的替代或一线选择。基因组异常最常见于L-LCNEC中,其次是类癌和SCLC。然而,由于L-LCNEC的发病率较低,其分子特征和治疗意义仍不清楚。到目前为止,只有少数携带ALK重排的L-LCNEC患者相关病例报道;然而,这些患者的治疗方法各不相同、 很少有患者接受过酪氨酸激酶抑制剂一线治疗。
本文报告了一例携带ALK突变的局部晚期L-LCNEC患者的病例,该患者接受了一线阿来替尼靶向治疗,显示出良好的疗效。
病 例
2020年11月18日,一名既往健康的46岁非吸烟女性因感冒后咳嗽和排痰到深圳市南山区蛇口人民医院就诊。胸部计算机断层扫描(CT)显示右叶有一个结节(无具体报告)。医院的医生建议住院进一步诊断和治疗,但患者很害怕并拒绝。随后,她用传统的中医药进行治疗。2021年6月13日,她因同样的原因到同一医院就诊,再次进行胸部CT检查发现,与2020年11月18日的CT相比 ,右肺上叶的病变比以前更多,纵隔淋巴结明显增大,很可能是周围型肺癌。
该患者于2021年6月16日住院治疗。在 2021年6月17日,胸部CT显示右肺上叶前段有一个19×16×30mm的结节状阴影,邻近胸膜受累,并在右侧肺门和纵隔的2R和4R / L(右/左)处观察到多个肿大的淋巴结。较大淋巴结的短直径约为21mm。上腔静脉腔因淋巴结推挤而变窄,并考虑淋巴结转移(图1)。2021年6月21日,进行了超声支气管镜检查,在纵膈的4R、4L和纵膈的7个区域、右肺门(10R)和右小叶间(11R)发现多个低回声肿块。病变的最大短直径约为20.4×30.6mm,在4R区(图2)。
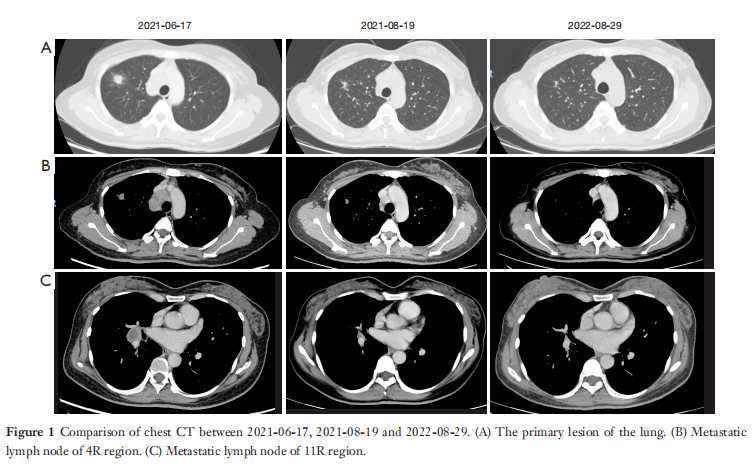
图1 2021-06-17、2021-08-19和2022-08-29的胸部CT对比。(A)肺部的原发病变。(B)4R区的转移性淋巴结。(C) 11R区的转移性淋巴结。
图2 超声支气管镜 (A)是4R区域的转移淋巴结(最大的淋巴结短直径为20.4×30.6mm)。(B) 是 11R区域的转移性淋巴结(最大的淋巴结短直径为12.9×21.6mm);在其中可以看到血流信号。
在超声引导下,用21g活检针在纵隔11R区和4R区进行经纤维支气管针吸活检术。2021年6月22日,病理结果显示11R和4R淋巴结低分化癌,结合免疫表型,符合神经内分泌癌,倾向于L-LCNEC。
免疫组织化学(IHC)结果:甲状腺转录因子1(TTF-1)、细胞角蛋白-7(CK7)、AE1/AE3、神经细胞黏附分子(NCAM、CD56)、嗜铬粒蛋白A(ChrA)、突触素(Syn)阳性,以及Ki-67阳性率为40%,但NapsinA、P40和P63为阴性(图3)。临床分期为cT1cN3M0 IIIB。对患者的血浆和肿瘤标本进行了NGS多基因检测,显示棘皮微管相关蛋白样4(EML-4)(外显子13)-ALK(外显子20)融合,突变丰度分别为14.48%和15.37%,微卫星稳定(MSS),肿瘤比例评分(TPS)0%,综合阳性得分(CPS)1。
图3 纵隔淋巴结穿刺术的病理结果 (A) 组织学10×HE。
(B)B组织学40×HE。 (C) 肿瘤表达Syn 20×HE。(D) 肿瘤表达CgA 20×HE。HE,苏木精和伊红。
经过胸部肿瘤外科医生的评估,医生建议术前进行2-4个周期的新辅助化疗,并进行综合评估以确定是否可以进行手术切除。患者因个人原因拒绝化疗,2021年7月18日,根据中国临床肿瘤学会(CSCO)2020年指南,患者开始使用ALK酪氨酸激酶抑制剂阿来替尼治疗,剂量为600 mg,每日两次。经阿来替尼治疗1个月后,肺肿瘤大小由19×16×30缩小至13×11×14 mm,最大肺门及纵隔淋巴结由21 mm缩小至14 mm,上腔静脉压力也有所下降(图1)。根据实体瘤疗效评估标准(RECIST1.1),该肿瘤反应判定为部分缓解(PR)。随后,患者每2个月接受一次检查,肿瘤继续缩小。2022年6月24日,患者做了正电子发射断层扫描(PET)-CT,仍有肿瘤残留,肿瘤大小与2022年4月28日相同。2022年8月29日,也就是阿来替尼治疗12个月后,肺部肿瘤大小已缩小到9×6 mm(与2022年4月28日胸部CT相比),肺门和纵隔淋巴结短直径为8 mm,癌胚抗原(CEA)水平继续下降(图4)。
图4 肿瘤标志物CEA逐渐降低。CEA,癌胚抗原。
与治疗相关的不良事件包括皮疹,在服药半个月后观察到皮疹出现在病人的手、脚和四肢上。根据NCI-CTCAE5.0标准,皮疹为2~3级。患者接受了抗过敏药物氯雷他定片、皮肤护理、内服外用中药等对症治疗,1个月后皮肤开始剥离。在2021年8月复查时,患者的皮疹已基本消失,虽然部分皮肤仍有色素(图5),但经过6个月的药物治疗,皮肤颜色已基本恢复正常。总体耐受性可接受,未观察到其他不良反应,患者能够正常生活和工作。病例的时间表如(图6)所示。
图5 治疗相关的不良皮疹。(A)手掌上出现皮疹。(B、C)对症治疗后,皮肤逐渐剥离,然后恢复正常。(D)手背出现皮疹。(E)对症治疗后皮疹消退,无色素沉着。(F)上肢出现皮疹。(G)在服药过程中,皮疹消退,但在对症治疗后仍有色素沉着。
图6 病例时间表。CT,计算机断层扫描;NGS,下一代测序;L-LCNEC,肺大细胞神经内分泌癌;NGS,下一代测序;EML4,棘皮微管相关蛋白样蛋白4;ALK,间变性淋巴瘤激酶
讨 论
L-LCNEC是一种罕见的高侵袭性肺癌,属于非小细胞肺癌的一种。Travis等人首次将其确定为肺癌的一种新亚型。2011年,世界卫生组织将L-LCNEC列为大细胞癌。在2015年与小细胞肺癌、典型类癌、不典型类癌一起被重新归类为肺部NET。大约20%的L-LCNEC有与SCLC或NSCLC混合的肿瘤成分。为了研究L-LCNEC与SCLC和NSCLC之间的生物学关系,Rekhtman等人分析了L-LCNEC和其他主要肺癌类型的基因组变化。发现L-LCNEC主要包括以下两个不同的亚群,具有不同的基因组特征:SCLC样亚型(特点是TP53+RB1共突变/缺失和其他SCLC类型改变);NSCLC样亚型(特点是缺乏TP53+RB1共变,几乎普遍出现STK11、KRAS和KEAP1的NSCLC型突变)。
已有研究确定L-LCNEC的生物学行为和预后。一些人认为L-LCNEC具有神经内分泌特征,应该被认为是小细胞癌。到目前为止,还没有随机对照试验来检验L-LCNEC的最佳治疗方案。Derks等人进行了一项回顾性研究,发现L-LCNEC是一种像小细胞肺癌一样有高度侵袭性的肺癌,在疾病的所有阶段预后都很差。然而,L-LCNEC和SCLC之间有重要的区别。值得注意的是,在IV期,L-LCNEC患者的预后比SCLC患者更差,然而,目前用于治疗早期L-LCNEC的治疗方法与用于治疗SCLC的方法不同。有研究表明,晚期L-LCNEC治疗方案,用小细胞肺癌的铂类化疗方案客观缓解率(37-52%)高于非小细胞肺癌铂类化疗方案(12-50%)。然而,患者的反应通常是短暂的,中位无进展生存(PFS)时间为4.6-6.1个月,中位总生存(OS)时间较差为10.2-11.1个月。另一项研究显示,接受化疗的IIIB和IV期L-CNEC患者预后不良,中位PFS时间为5.2个月,OS时间为5.2个月。
L-LCNEC IHC的主要特征是表达神经内分泌相关标记物,如CD56、CgA和Syn,可作为NSCLC病理鉴别诊断的标志物。在本文中,我们报告了一个罕见的病例,患者被诊断为神经内分泌癌,很可能是大细胞神经内分泌癌。免疫组化检测的结果是,如CD56、 ChrA和Syno等神经内分泌标志物均为阳性。
酪氨酸激酶的基因突变在肺腺癌的发病机制中起着重要作用。携带ALK重排的肿瘤可以用ALK抑制剂成功治疗。ALK重排在肺腺癌中最为常见。
携带ALK重排的L-LCNEC非常罕见,目前还没有针对这种疾病进行大规模的临床试验。然而,报道称ALK阳性的肿瘤通常表达TTF-1。本例患者为TTF-1阳性(3+),但经与本院病理科沟通,确诊患者为单纯性L-LCNEC。此外,在患者的基因检测结果中没有检测到TP53+RB1共突变,推测患者患有一种类似NSCLC样亚型。
目前,肿瘤的治疗模式比几十年更加个性化和精准化。CSCO和国家综合癌症网络发布的NSCLC指南均建议患者接受多基因检测,以明确分子分型。本文患者进行了NGS检测,检出EML4-ALK(E13:A20)重排(融合),这是最常见的重排(融合)位点。近年来,已有多个病例报道L-LCNEC存在ALK重排。事实上,最早的两例L-LCNEC报告就报告了ALK重排。第一个案例涉及到一名43岁的女性,她从未吸烟,并在一线接受了克唑替尼的靶向治疗。经过6周的治疗,出现脑转移和皮肤转移,这表明肿瘤对克唑替尼具有耐药性。第二个病例是一名60岁的女性,她从不吸烟,也没有接受任何ALK抑制剂。此外,Hayashi等人报告了一例75岁、不吸烟的女性,被诊断为L-LCNEC合并多发性肝脏和骨转移。经过7个周期的细胞毒性药物化疗后,基因检测显示ALK重排。随后服用了阿来替尼。约1个月后,肿瘤标志物神经元特异性烯醇化酶(NSE)和胃泌素释放肽前体(ProGRP)降至正常范围,4个月后,肺部病变由21 mm缩小至16 mm,肝脏病变消退,患者达到PR。经过6个月的治疗,正电子发射断层扫描-CT显示病情稳定。本病例中患者处于cT1cN3M0 IIIB临床分期阶段,当时尚无手术指征。这名患者因个人原因拒绝化疗,并要求进行靶向治疗。
根据ALESIA中III期临床研究结果。2018年,中国国家药品监督管理局批准阿来替尼用于治疗ALK阳性的局部晚期或转移性非小细胞肺癌,包括作为一线治疗药物或克唑替尼治疗进展后的二线药物。由于阿来替尼一线治疗的中位PFS时间为34.8个月,CSCO指南建议将其作为ALK阳性患者的一线治疗。
在本病例中,经过阿来替尼1个月的靶向治疗后,肿瘤显著缩小,患者实现了PR。然后每两个月定期检查一次肿瘤,并继续缩小。治疗1年后,对肿瘤进行复查,维持PR状态。治疗初期出现2~3级皮疹,治疗后皮疹迅速好转,未再出现。未观察到其他不良反应,患者能够正常生活和工作。
先前的研究表明,对于晚期L-LCNEC,姑息化疗对于SCLC比NSCLC更适用。免疫治疗也被尝试用于治疗L-LCNEC。对于适合进行靶向治疗的患者,一线靶向治疗也是一个不错的选择,未来还需要更多的试验和研究,以探索L-LCNEC的最佳和合适的治疗方法。在这种情况下,遗憾的是最初没有为患者进行ALK免疫组化检测,我们将在以后改进相关的免疫组化检测。
对于具有不能切除的III期和0-1级功能状态的NSCLC患者,建议进行多学科小组讨论,根据2020年CSCO指南的一级推荐,根治性同步放化疗或度伐利尤单抗作为同期放化疗后的巩固治疗。对于IV期驱动基因阳性的非小细胞肺癌患者首选靶向治疗。但对于拒绝化疗并有基因突变的III期患者来说,靶向治疗也是一个很好的选择,上述病例中,患者选择了靶向治疗,拒绝了化疗和手术,她取得了良好的疗效,没有明显的严重副作用,提高了生活质量。
参考文献:Chen D, Ma S, Sun L, Lang Y, Yang B. EML4-ALK rearrangement of lung large cell neuroendocrine carcinoma: a case report. Ann Transl Med. 2023 Jan 31;11(2):134. doi: 10.21037/atm-22-6062. Epub 2023 Jan 11. PMID: 36819595; PMCID: PMC9929752.