近期發表在《臨床腫瘤學》雜誌上的一項 1/2a 期研究數據表明(NCT04036682),zipalertinib(CLN-081,TAS6417)在經過多線治療且攜帶EGFR 20 號外顯子插入突變(ex20ins)的復發性或轉移性非小細胞肺癌(NSCLC)患者中表現出良好的療效和可接受的安全性。目前臨床 3 期REZILIENT3研究(NCT05973773)已經開展,這標誌著zipalertinib向正式獲批邁出了重要一步,有望在未來幫助更多的EGFR ex20ins突變NSCLC患者。
Taiho Oncology, Inc.臨床開發高級副總裁Volker Wacheck博士在一份新聞稿中表示:「眾所周知,攜帶EGFR 20 號外顯子插入突變的NSCLC患者比常見EGFR突變的患者預後更差。優化這部分患者的治療決策有助於推動非小細胞肺癌領域的進展。」
相關背景
EGFR ex20ins與NSCLC
人表皮生長因子受體(EGFR)基因是亞洲NSCLC患者最常見的驅動基因,主要表現為 19 號外顯子缺失(19del)以及 21 號外顯子突變兩種敏感突變,全球新發的非小細胞肺癌患者數超過 200 萬,EGFR突變患者數就超過了 60 萬。中國NSCLC患者EGFR突變率約50.3%。
隨著基因檢測技術的提升,越來越多的EGFR突變亞型陸陸續續被發現。其中,EGFR 20號外顯子插入突變(ex20ins)作為EGFR非經典突變中最常見的類型,目前已經成為EGFR突變治療道路上的一道阻礙。EGFR ex20ins發生率約占所有非經典突變類型的 50% 左右,占整體EGFR突變型NSCLC的 13% 左右。由於EGFR ex20ins亞型眾多,並且結構與EGFR野生型相似,導致藥物開發難度大,一度被業內稱為不可成藥(undraggable)靶點。
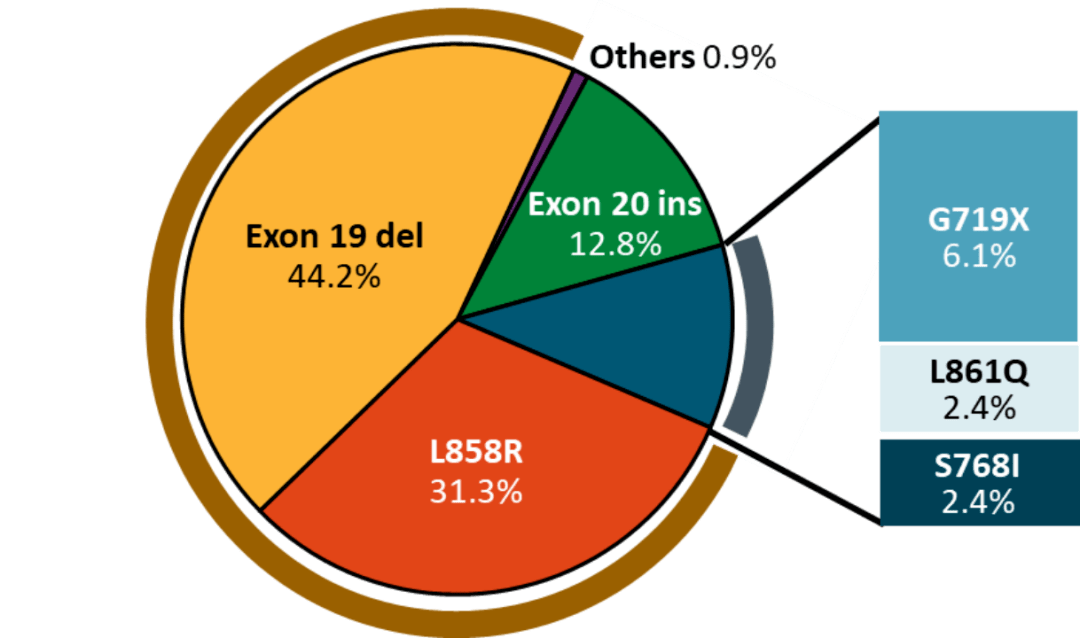
NSCLC中常見的EGFR突變亞型
EGFR受體結構及EGFR ex20主要插入位點
Zipalertinib(CLN-081,TAS6417)
zipalertinib結構
隨著研究的進展,EGFR ex20ins這一靶點也得到了攻克。Zipalertinib是一種口服不可逆 EGFR 抑制劑,選擇性靶向攜帶EGFR ex20ins的細胞,同時保留表達野生型EGFR的細胞。2022 年 1 月 4 日,Cullinan Oncology, Inc.宣布美國食品和藥品監督管理局(FDA)授予zipalertinib突破性療法認定,用於先前接受過含鉑化療的、攜帶EGFR突變的局部晚期或轉移性NSCLC患者。
Cullinan Oncology, Inc.宣布zipalertinib獲FDA突破性療法認定
Zipalertinib由Taiho Oncology, Inc.、其母公司Taiho Pharmaceutical Co., Ltd.和Cullinan Oncology, Inc.開發。2020 年將zipalertinib在大中華區的權利授權給再鼎醫藥有限公司。
相關研究
NCT04036682
這是一項 1/2a 期研究,評估了zipalertinib的抗腫瘤活性、安全性、耐受性和藥代動力學(PK)特性。
- 研究設計
研究納入了 73 名經組織學或細胞學證實為復發和/或轉移性NSCLC,且攜帶EGFR ex20ins突變的成人患者。這些患者先前接受過中位 2 線系統性治療(範圍 1-9);36% 接受過非靶向EGFR ex20ins酪氨酸激酶抑制劑,4% 接受過靶向EGFR ex20ins酪氨酸激酶抑制劑。入組患者每日口服 2 次zipalertinib,每個治療周期持續 21 天。在基線期、第 6 周、第 15 周、第 24 周、第 33 周、第 42 周,以及之後每 12 周進行一次腫瘤評估。對於有中樞神經系統(CNS)轉移病史的患者,每次再分期都需要進行腦部影像學檢查。患者會持續接受治療,直到出現疾病進展、不可接受的不良反應、撤回同意或研究人員決定停止。安全性評估,包括臨床和實驗室評估,在基線和治療期間定期進行。不良事件(AE)的嚴重程度根據CTCAE 5.0版進行分級。劑量限制毒性(DLT)是根據在第一個 21 天的治療周期中觀察到的與治療相關的AE(TRAE)來定義的。
- 研究結果
所有劑量水平中最佳緩解狀態
不同劑量水平下腫瘤隨時間緩解情況
在所有劑量水平中,38.4%(28/73)患者有確認的客觀緩解(OR),57.5% 的患者疾病穩定,4.1% 的患者疾病進展,疾病控制率(DCR)高達 95.9% 。中位至症狀緩解時間(TTR)為 1.5 個月(範圍1.5-6.2),74% 的患者在前六周的疾病評估時經歷了腫瘤消退,包括 33% 的OR(24/73),以及首次影像檢查時 59% 的SD(疾病穩定,43/73)。
不同劑量水平下的PFS曲線
中位隨訪時間 11 個月時,所有劑量水平的中位緩解持續時間(mDOR)為 10 個月(95% CI,6-NC)。在數據截止時,16 例 100 mg治療的患者和 12 例 ≤65 mg治療的未達到mDOR。所有劑量水平的中位無進展生存期(mPFS)為 10 個月(95% CI,6-12),每日兩次 100 mg劑量水平下的mPFS為 12 個月(95% CI,5-NC),每日兩次 65 mg或更少劑量水平下的mPFS為 8 個月(95%CI,5-13)。
Zipalertinib在EGFR ex20ins突變NSCLC患者中的臨床活性
在 26 例接受EGFR抑制劑(非ex20ins抑制劑)後接受zipalertinib的患者中,8 例(31%)取得了PR,13例(50%)SD,2例(8%)疾病進展。在 3 例既往接受另一種ex20ins TKI(波齊替尼、莫博賽替尼或兩者聯合使用)治療的患者中,有 2 例PR和1例SD。在一項探索性分析中,近環插入患者OR率為 41.5%,遠環插入的患者OR率為 22% 。
此外,zipalertinib在中樞神經系統(CNS)轉移患者中具有一定的活性。在 3 名腦部具有可測量病變的患者中,1 名經歷了全身和顱內PR,1 名經歷了全身和顱內SD,1 名出現了CNS進展。
- 研究結論
總之,zipalertinib作為一種新型口服EGFR抑制劑,ORR和PFS證實具有令人鼓舞的抗腫瘤活性,在經過多線治療的EGFR突變NSCLC的患者中具有可接受的安全性,並降低了EGFR野生型的相關毒性,有望成為這些患者的一種替代治療選擇。
REZILIENT3研究
REZILIENT3(NCT05973773)是一項 3 期研究,旨在評估zipalertinib聯合含鉑化療在攜帶EGFR ex20ins突變的局部晚期或轉移性非鱗狀NSCLC中的療效和安全性。
- 研究設計
研究設計
在這項隨機、對照、開放標籤、3 期、全球、多中心研究中,研究人員計劃從安全性導入評估(A部分)開始,以確定zipalertinib的推薦劑量。A部分將包括 6-12 名EGFR ex20ins突變陽性NSCLC患者,他們將接受zipalertinib+培美曲塞+卡鉑/順鉑治療,周期為 21 天。A部分的治療將持續到PD或無法耐受。Zipalertinib的推薦劑量將根據第一個治療周期觀察到的劑量限制毒性(DLT)情況來確定。A部分結束後,將開始B部分。在B部分中,300 名患者將按照 1:1 的比例隨機分配接受zipalertinib聯合化療或僅接受化療。
研究的主要終點是TEAE的發生率和嚴重程度以及PFS。A部分的主要終點是確定DLT的發生率和嚴重程度。研究的次要終點包括客觀緩解率(ORR)、疾病控制率(DCR)、緩解持續時間(DOR)、總生存期(OS)、生活質量(QOL)、藥代動力學(PK)和EGFR突變狀態。
- 研究結果
目前該研究正在進行中,預計 2027 年 4 月 21 日發布最終數據。
- 研究意義
Cullinan Oncology, Inc首席醫療官Jeffrey Jones醫學博士表示:「在一線治療中啟動關於zipalertinib的 3 期試驗是向前邁出的重要一步,因為它代表著zipalertinib有機會幫助更多EGFR ex20ins突變NSCLC患者。」
其它EGFR ex20ins突變靶向藥
FDA批准藥物
目前,FDA批准了兩款EGFR ex20ins靶向藥,一款是埃萬妥單抗(Amivantamab,Rybrevant),一款是莫博賽替尼(Mobocertinib,Exkivity)。
- 埃萬妥單抗
FDA加速批准埃萬妥單抗用於轉移性非小細胞肺癌
2021 年 5 月 21 日,FDA加速批准埃萬妥單抗用於局部晚期或轉移性EGFR ex20ins插入突變NSCLC成年患者,這些患者曾在先前的含鉑化療中或之後進展。這項批準是基於CHRYSALIS研究的結果——中位隨訪 9.7 個月後,接受埃萬妥單抗治療後的客觀緩解率ORR為 40% ,其中完全緩解CR為 4% ,部分緩解率PR為 36% 。中位持續緩解時間DOR為 11.1 個月。臨床獲益率CBR(定義為至少兩次疾病評估中CR或PR或SD)為 74% 。中位PFS為 8.3 個月,中位OS為 22.8 個月。
盲法獨立審查中心評估的療效數據
- 莫博賽替尼
FDA加速批准莫博賽替尼用於攜帶EGFR ex20ins插入突變的轉移性非小細胞肺癌
2021 年 10 月 15 日,FDA加速批准莫博賽替尼用於攜帶EGFR ex20ins插入突變的局部晚期或轉移性NSCLC成人患者,這些患者曾在先前的含鉑化療中或之後出現疾病進展。這項批準是基於 101 研究的結果——基於RECIST V1.1標準,ORR為 28%(95%CI,20%-37%),中位緩解持續時間為17.5個月(95%CI,7.4-20.3)。
莫博賽替尼的療效數據
在 2022 年ESMO上還報告了一項莫博賽替尼治療的EGFR ex20ins突變型NSCLC患者的真實世界研究數據。該研究納入了 982 例患者,其中約81%既往接受過含鉑化療。患者分別接受莫博賽替尼與其他治療方法(包括傳統EGFR-TKI、免疫治療、化療或聯合治療,稱為RWD組),對比療效差異。結果顯示莫博賽替尼組和RWD組的ORR分別為 35% 和 12% ,中位PFS分別為 7.3 個月和 3.3 個月,中位OS分別為 24.0 個月和 12.4 個月(HR=0.53)。
NMPA批准藥物
- 莫博賽替尼
NMPA附條件批准莫博賽替尼上市
目前,NMPA(國家藥品監督管理局)批准莫博賽替尼用於EGFR ex20ins突變NSCLC。莫博賽替尼在國內的獲批基於Exkivity I/II期(NCT02716116)臨床研究結果,該研究納入了 114 例既往接受過含鉑化療的EGFR 20ins的NSCLC患者,經研究者評估的結果顯示,ORR達到了 35%,DCR達到 78%,DOR達到 15.8 個月,mPFS達到 7.3 個月,mOS達到了 20.2 個月。
莫博賽替尼在I/II期研究中,顯著改善了PPP(鉑類經治患者)隊列PFS與OS(圖源2022年ESMO)
其它在研藥物
除了上述的兩款靶向藥,還有其它藥物在EGFR ex20ins突變NSCLC中展現了一定的療效,如國產藥物舒沃替尼、伏美替尼、JMT-101和PLB1004。
- 舒沃替尼(DZD9008)
舒沃替尼(sunvozertinib,DZD9008)是由迪哲(江蘇)醫藥有限公司研發的新型選擇性、不可逆的EGFR/HER2抑制劑。據悉,這款藥物對約 30 種EGFR外顯子 20 插入亞型,無論突變位置如何,都具有抗腫瘤活性。此外,舒沃替尼作為一款口服藥,在臨床前研究和臨床研究中都表現出理想的藥物代謝和藥代動力學(DMPK)特性。非臨床毒性研究證實,舒沃替尼具有良好的安全性,支持其在臨床中應用。
舒沃替尼用於EGFR ex20ins突變NSCLC後線治療的WUKONG 6(CTR20211009)研究已公布截止至 2022 年 7 月 31 日的數據分析結果。基線特徵顯示,32% 的患者基線伴腦轉移;既往系統抗腫瘤治療線數(範圍)為一線至三線,其中 50.5% 的患者既往接受過二線及以上治療,34% 的患者既往接受過免疫治療,25.8% 患者既往接受過EGFR-TKI治療;在 300 mg、每日一次的推薦劑量下,在既往含鉑化療經治EGFR ex20ins突變NSCLC患者(n = 97)中,BICR評估的cORR為 59.8%(58/97),對於基線伴有腦轉移的患者,cORR為 48.4% 。2023 年ASCO會議上公布了有關舒沃替尼的最新數據,詳情請關注往期推文:ORR達60.8%!舒沃替尼治療EGFR ex20ins NSCLC數據閃耀2023 ASCO
舒沃替尼憑藉出色的療效和安全性,分別於 2020 年和 2022 年獲得中國、美國突破性療法認定(BTD),成為迄今為止肺癌領域首個且唯一獲得中美兩國雙BTD的 I 類新藥,現處於全球註冊臨床階段。
迪哲醫藥宣布FDA授予舒沃替尼突破性療法認定,用於治療先前接受含鉑化療期間或之後病情進展、經檢測證實為EGFR 20 ins突變的局部晚期或轉移性NSCLC患者
2023 年 1 月 10 日,舒沃替尼的新藥上市申請獲國家藥品監督管理局受理並納入優先審評,用於既往接受過鉑類化療、攜帶EGFR ex20ins的局部晚期或轉移性NSCLC患者。
舒沃替尼獲CDE優先審評
- 伏美替尼(艾弗沙)
伏美替尼是上海艾力斯醫藥科技股份有限公司研發的第三代EGFR抑制劑,2021 年 3 月在國內獲批上市,用於治療EGFR T790M突變型非小細胞肺癌。其IB期研究FAVOUR(NCT04858958)隊列 1 納入了 10 例EGFR ex20ins突變NSCLC初治患者,截止 2021 年 6 月試驗數據顯示伏美替尼治療EGFR突變NSCLC的IRC評估的cORR為 60% ,INV評估的cORR為 70% ,初步顯示出良好的抗腫瘤活性和耐受性,期待更大樣本量的研究進一步驗證其療效。目前正在開展新適應證臨床 3 期研究,旨在探索一線治療EGFR ex20ins突變NSCLC的療效和安全性。
艾力斯宣布伏美替尼用於EGFR ex20ins突變NSCLC一線治療的3期臨床研究開始
(向上滑動閱覽)
參考文獻:
[1]Zipalertinib Shows Antitumor Activity and a Manageable Safety Profile in EGFR Exon 20+ NSCLC.https://www.onclive.com/view/zipalertinib-shows-antitumor-activity-and-a-manageable-safety-profile-in-egfr-exon-20-nsclc
[2]Zipalertinib Plus Chemotherapy Moves to Phase 3 Study in EGFR Exon 20 Insertion+ NSCLC.https://www.onclive.com/view/zipalertinib-plus-chemotherapy-moves-to-phase-3-study-in-egfr-exon-20-insertion-nsclc
[3]Piotrowska Z, Tan DSW, Smit EF, et al. Safety, tolerability, and antitumor activity of zipalertinib among patients with non-small-cell lung cancer harboring epidermal growth factor receptor exon 20 insertions. J Clin Oncol. Published online June 29, 2023. doi:10.1200/JCO.23.00152
[4]Rezilient3 global first-line trial of zipalertinib launched in patients with non-small cell lung cancer harboring EGFR exon 20 insertion mutations. News release. Taiho Oncology. August 3, 2023. Accessed August 4, 2023. https://www.taihooncology.com/us/news/2023-08-03_zipalertnib_phase3/
[5]Yu HA, Tan DSW, Smit EF, et al. Phase (Ph) 1/2a study of CLN-081 in patients (pts) with NSCLC with EGFR exon 20 insertion mutations (Ins20). J Clin Oncol. 2022;40(suppl 16):9007. doi:10.1200/JCO.2022.40.16_suppl.9007
[6]FDA官網
[7]NMPA官網
[8]艾力斯官網
[9}Wang M, Fan Y, Sun M, et al. Sunvozertinib for the treatment of NSCLC with EGFR Exon20 insertion mutations: The first pivotal study results. J Clin Oncol. 2023; 41 (suppl 16):9002-9002. doi: 10.1200/JCO.2023.41.16_suppl.9002
[10]Russo A,Franchina T,Ricciardi G,et al. Heterogeneous Responses to Epidermal Growth Factor Receptor (EGFR) Tyrosine Kinase Inhibitors (TKIs) in Patients with Uncommon EGFR Mutations: New Insights and Future Perspectives in this Complex Clinical Scenario[J]. Int J Mol Sci,2019,20( 6) : 1431.
[11]Remon J, Hendriks LEL, Cardona AF, Besse B. EGFR exon 20 insertions in advanced non-small cell lung cancer: A new history begins. Cancer Treat Rev. 2020 Nov;90:102105. doi: 10.1016/j.ctrv.2020.102105. Epub 2020 Sep 14. PMID: 32979839.